Papier photocatalytique flexible avec nanotiges de ZnO décorées de nanoparticules de Cu2O et d'Ag pour la photodégradation à la lumière visible des colorants organiques
Résumé
Nous rapportons la fabrication de papier photocatalytique flexible composé de Cu2 Nanotiges de ZnO (NR) décorées de nanoparticules d'O et d'Ag (NP) et son application dans la photodégradation à la lumière visible d'un colorant organique. Les ZnO NR sont d'abord cultivés sur un substrat de papier kraft en utilisant une méthode hydrothermale. Les NR sont ensuite décorés de Cu2 O, Ag ou les deux NP formés par des processus de photoréduction. La microscopie électronique à balayage et l'analyse par diffraction des rayons X confirment la cristallinité des ZnO NR. L'analyse en microscopie électronique à transmission confirme les compositions des deux types de NP. Quatre types différents de papiers photocatalytiques d'un format de 10 × 10 cm 2 sont préparés et utilisés pour dégrader une solution de rhodamine B à 10 µM et 100 mL. Le papier avec Cu2 Les ZnO NR co-décorés par O et Ag NP ont la meilleure efficacité avec des constantes cinétiques de premier ordre de 0,017 et 0,041 min −1 sous l'éclairage d'une lampe halogène et la lumière directe du soleil, respectivement. Les performances du papier photocatalytique se comparent bien à celles d'autres photocatalyseurs nanocomposites ZnO supportés par un substrat. Avec les avantages de la flexibilité, du poids léger, de la non-toxicité, du faible coût et de la facilité de fabrication, le papier photocatalytique a un bon potentiel pour la photocatalyse à la lumière visible.
Introduction
Les nanomatériaux d'oxyde métallique ont fait l'objet de recherches approfondies au cours des deux dernières décennies pour leurs applications généralisées dans les domaines de la photonique, de l'électronique, de l'énergie, de la détection, de la protection de l'environnement, etc. [1,2,3,4,5,6]. Parmi eux, les rapports sur les nanomatériaux de ZnO ont été particulièrement abondants en raison de la facilité de croissance et du contrôle de la morphologie [1, 2]. La photocatalyse utilisant des nanotiges de ZnO (NR) supportées par un substrat pour la photodégradation de colorant organique est une application potentiellement importante [2, 7, 8]. Les ZnO NR offrent les avantages de positions de bandes d'énergie adaptées, de nature non toxique, de facilité de croissance, de faible coût, etc. L'utilisation de nanomatériaux supportés par un substrat évite également un processus de séparation après dégradation du colorant par rapport à l'utilisation de nanomatériaux dispersés.
La dégradation du colorant organique est due au fort pouvoir oxydant des radicaux hydroxyles, et la génération de radicaux hydroxyles est basée sur les équations suivantes [7, 8] :
$$ {\mathrm{OH}}^{-}+{h}^{+}\à {}^{\bullet}\mathrm{O}\mathrm{H} $$ (1) $$ {\mathrm {H}}_2\mathrm{O}+{h}^{+}\à {\mathrm{H}}^{+}+{}^{\bullet}\mathrm{O}\mathrm{H} $ $ (2) $$ {\mathrm{O}}_2+{e}^{-}\à {\mathrm{O}}_2^{\bullet -} $$ (3) $$ {\mathrm{O} }_2^{\bullet -}+{\mathrm{H}}^{+}\à {\mathrm{H}\mathrm{O}}_2^{\bullet } $$ (4) $$ {\mathrm {O}}_2^{\bullet -}+{\mathrm{H}}^{+}+{\mathrm{H}\mathrm{O}}_2^{\bullet}\à {\mathrm{H} }_2{\mathrm{O}}_2+{\mathrm{O}}_2 $$ (5) $$ {\mathrm{H}}_2{\mathrm{O}}_2+{e}^{-}\to {}^{\bullet}\mathrm{O}\mathrm{H}+{\mathrm{O}\mathrm{H}}^{-} $$ (6)Comme le ZnO est un semi-conducteur à large bande interdite, une approche couramment appliquée consiste à décorer les NR avec des nanoparticules semi-conductrices à bande interdite étroite (NP) pour étendre l'absorption de la lumière vers le domaine visible. Les NP de métaux nobles ont également été utilisées dans le même but en raison de la forte absorption de la lumière visible causée par l'effet plasmonique [9]. Une autre préoccupation importante est que la recombinaison des paires électron-trou photogénérées est élevée en ZnO et la suppression de la recombinaison est cruciale pour la photocatalyse [7]. L'interface d'hétérojonction NR et NP facilite la séparation des charges et améliore ainsi la photocatalyse. Rapports de ZnO NR décorés avec divers types de NP (ou alternativement appelés nanocomposites) tels que ZnSe [10], Ag2 S [11], CdS [11,12,13], CuO [14], Cu2 O [15, 16], ZnFe2 O4 [17], Ag [16, 18, 19] et Au [12, 20] sont abondants dans la littérature.
Pour la photocatalyse à la lumière visible, il semble raisonnable de décorer les NR de ZnO avec les NP susmentionnés en grande quantité pour obtenir un rendement élevé. Cependant, une décoration excessive de semi-conducteurs à bande interdite étroite ou de NP de métaux nobles a des effets néfastes pour les raisons suivantes. Premièrement, les trous dans un semi-conducteur à bande interdite étroite n'ont généralement pas suffisamment d'énergie pour oxyder les ions hydroxyde (voir l'équation (1)) ou les molécules d'eau (voir l'équation (2)) en radicaux hydroxyle. (Les potentiels de réduction des réactions chimiques pour la formation de radicaux hydroxyle seront mentionnés plus tard.) Deuxièmement, l'absorption visible induite par l'effet plasmonique d'un métal noble NP ne produit que des électrons de haute énergie mais pas de trous. La génération de radicaux hydroxyles due aux électrons nécessite une séquence de réactions chimiques (voir Eq. (3) à Eq. (6)) et n'est pas aussi efficace que les trous. Troisièmement, la présence de défauts dans les ZnO NR est courante [21], et les défauts sont capables d'absorber la lumière visible [22]. Les trous photogénérés dus à l'absorption des défauts dans le ZnO ont une énergie suffisante pour générer des radicaux hydroxyles.
Par conséquent, la décoration simultanée avec à la fois des semi-conducteurs à bande interdite étroite et des NP de métaux nobles semble une approche rationnelle pour atteindre un rendement élevé. Peu de travaux ont été rapportés jusqu'à présent, et en effet, une efficacité de photodégradation plus élevée a été obtenue par rapport à une décoration simple [12, 16]. Les avantages de la décoration simultanée seraient une meilleure absorption de la lumière visible des NP semi-conducteurs et un transfert d'électrons plus rapide dans le nanocomposite ternaire, tous deux attribués à l'effet plasmonique des NP de métaux nobles [12].
Pour des applications pratiques, il est souhaitable de faire croître des ZnO NR sur des substrats flexibles. La croissance de ZnO NR sur des substrats plastiques a été bien étudiée [23, 24]. Au cours des dernières années, la croissance des ZnO NR sur les substrats en papier a commencé à attirer l'attention de la recherche [25,26,27,28,29] car le papier est flexible, léger, peu coûteux, respectueux de l'environnement et facile à manipuler. Cependant, les rapports sur la croissance de ZnO NR décorés de NP sur des substrats en papier sont rares. De plus, les travaux précédemment rapportés sur les ZnO NR cultivés sur des substrats en papier sont principalement liés à l'électronique et à la détection [25,26,27,28] et très peu liés à la photocatalyse [29]. Dans le présent travail, nous rapportons la croissance en solution de Cu2 O et Ag décorés de NP de ZnO NR sur papier. Les bonnes performances photocatalytiques du papier photocatalytique sont vérifiées par la dégradation d'une solution de rhodamine B (RhB).
Méthodes
Croissance des ZnO NR sur papier
Les ZnO NR ont été cultivés sur un substrat de papier kraft en utilisant la méthode hydrothermale [1, 2, 7]. Tout d'abord, une solution d'ensemencement de ZnO a été préparée à l'aide d'une solution mixte d'acétate de zinc 10 mM et d'hydroxyde de sodium 3 mM (à la fois dans de l'éthanol et un rapport volumique 1:2) chauffée à 72 °C pendant 3 h. Deuxièmement, la solution de graines a été versée sur un 10 × 10 cm 2 substrat de papier kraft chauffé à 90°C pour former une couche d'ensemencement de ZnO. Troisièmement, le substrat en papier avec la couche d'ensemencement de ZnO a été immergé dans une solution de nitrate de zinc 25 mM et d'hexaméthylènetétramine 25 mM (HMTA, C6 H12 N4 ) (à la fois dans de l'eau déminéralisée et un rapport volumique de 1:1) et chauffé à 95 °C pendant 7 h dans un récipient fermé. Le substrat en papier a été retiré de la solution, rincé plusieurs fois avec de l'eau déminéralisée et séché avec de l'azote gazeux.
Décoration de Cu2 O et Ag NPs sur ZnO NRs
Pour la décoration de surface avec Cu2 O NPs, un substrat de papier NR a été immergé dans un CuSO4 0,1 mM solution et soumis à une irradiation ultraviolette (UV) de trois lampes de 1 W et 254 nm pendant 1,5 h à 60 °C. Pour la décoration de surface avec Ag NPs, un substrat de papier NR a été immergé dans un AgNO3 50 mM solution et soumis à une irradiation UV pendant 1 min. Les créations de Cu2 Les NP O et Ag sont basées sur les réactions chimiques suivantes :
$$ \mathrm{ZnO}+ h\nu \to \mathrm{ZnO}+{h}^{+}+{e}^{-} $$ (7) $$ {\mathrm{Cu}}^{ 2+}+2{e}^{-}\à \mathrm{Cu} $$ (8) $$ {\mathrm{Cu}}^{2+}+\mathrm{Cu}+{\mathrm{H }}_2\mathrm{O}\à {\mathrm{Cu}}_2\mathrm{O}+2{\mathrm{H}}^{+} $$ (9) $$ {\mathrm{Ag}} ^{+}+{e}^{-}\à \mathrm{Ag} $$ (10) $$ 2{\mathrm{H}}_2\mathrm{O}+4{h}^{+}\ à 4{\mathrm{H}}^{+}+{\mathrm{O}}_2 $$ (11)Après la décoration de la surface, le substrat en papier a été rincé plusieurs fois avec de l'eau désionisée et séché sous azote gazeux. Pour la décoration avec les deux types de NP, le Cu2 Le décor O a été réalisé en premier puis le décor Ag. Quatre types différents de papiers photocatalytiques ont été préparés et désignés comme ZnO, Cu2 O/ZnO, Ag/ZnO et Ag/Cu2 O/ZnO.
Mesure photocatalytique
L'activité photocatalytique a été évaluée en dégradant une solution de 100 mL, 10-μM (~ 4,8 ppm) de RhB sous l'éclairage d'une lampe halogène de 300 W. Le papier photocatalytique utilisé a d'abord été immergé dans une solution de RhB dans l'obscurité pendant 1 h, et une nouvelle solution a été utilisée pour la photodégradation. Un petit moteur a été utilisé pour agiter la solution. Une goutte de 50 μL a été prélevée toutes les 10 min pendant la photodégradation. Les spectres d'absorption des gouttes recueillies à différents moments ont été mesurés à l'aide d'un microscope optique équipé d'un spectromètre à matrice de photodiodes en Si connecté par fibre.
Résultats et discussion
La figure 1a montre des photographies d'un 10 × 10 cm 2 papier kraft et le papier avec ZnO NR tel que cultivé. Le papier kraft brun devient gris après la croissance des ZnO NR sur le papier. Le papier a été roulé plusieurs fois pour former une surface cylindrique (avec un rayon d'environ 2 cm) à plusieurs reprises, et aucune fissure montrant la perte de NR n'est trouvée lorsque le papier est examiné à l'aide d'un microscope optique. La figure 1b est une image en microscopie électronique à balayage (MEB) du papier ZnO. La figure 1c est une image SEM des ZnO NR. Les NRs ont une forme hexagonale avec des diamètres compris entre 50 et 300 nm. Images SEM de Cu2 O/ZnO, Ag/ZnO et Ag/Cu2 Les NR O/ZnO sont représentés sur la figure 1 d, e et f, respectivement. Une petite quantité de Cu2 O et Ag NPs peuvent être vus sur les surfaces NR.

un Photographies d'un substrat de papier kraft (à gauche) et du papier avec des ZnO NR tels que cultivés (à droite). b Images SEM du papier ZnO NR. c –f Images SEM de ZnO, Cu2 O/ZnO, Ag/ZnO et Ag/Cu2 O/ZnO NR, respectivement
Les spectres de spectroscopie à dispersion d'énergie (EDS) du Cu2 O/ZnO, Ag/ZnO et Ag/Cu2 Les NR O/ZnO sont représentés sur les figures 2a–c, respectivement. Les éléments correspondants liés aux pics sont également indiqués. Comme prévu, les pics Zn et O sont les pics dominants dans les spectres. Les pics de Pt proviennent du revêtement métallique lors de la prise d'images SEM. Des pics de Cu, qui sont proches des pics de Zn, peuvent être observés sur la figure 2a, indiquant la présence d'oxyde de cuivre. Un pic d'Ag est visible sur la figure 2b, indiquant la présence d'argent ou d'oxyde d'argent. Les pics Cu et Ag se trouvent tous deux sur la figure 2c, indiquant le succès de la co-décoration.
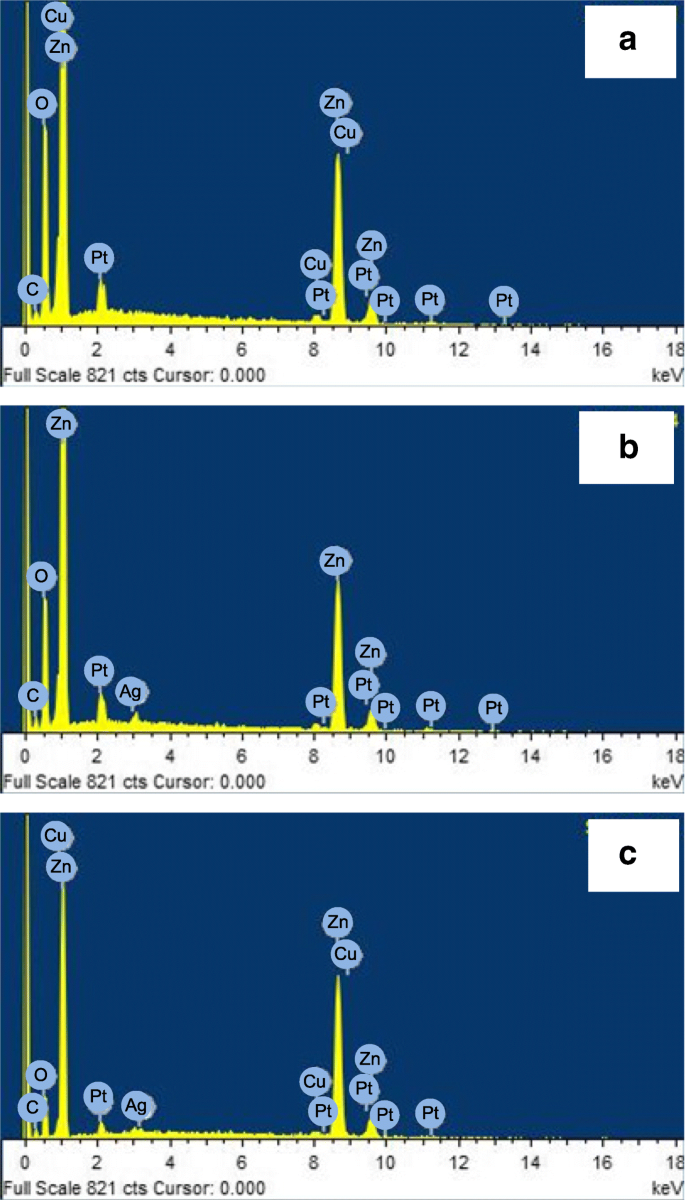
a–c Spectres EDS du Cu2 O/ZnO, Ag/ZnO et Ag/Cu2 O/ZnO NR, respectivement
La figure 3a est une image en microscopie électronique à transmission (MET) d'un Ag/Cu2 O/ZnO NR. Images MET haute résolution d'un Cu2 O et un Ag NP sont représentés sur les figures 3 b et c, respectivement. Modèles de transformée de Fourier du Cu2 O et Ag NP sont révélés respectivement sur les figures 3d et e. Dans la figure 4a, l'espacement interplanaire \( \left(2\kern0.5em \overline{1}\kern0.5em 1\right) \) est déterminé à 0,179 nm, ce qui est cohérent avec le (2 1 1) espacement de 0,174 nm pour Cu2 O dans les fiches du Joint Committee on Powder Diffraction Standards (JCPDS). Dans la figure 4b, l'espacement interplanaire \( \left(1\kern0.5em \overline{1}\;\overline{1}\right) \) est déterminé à 0,236 nm, ce qui est cohérent avec le (1 1 1) espacement de 0,236 nm pour Ag dans les fichiers de la carte JCPDS. Il est ainsi confirmé que les deux types de NP se forment sur la surface NR.

un Une image TEM d'un Ag/Cu2 O/ZnO NR. b , c Images MET haute résolution d'un Cu2 O et un Ag NP, respectivement. d , e Modèles de transformée de Fourier du Cu2 O et Ag NP, respectivement

un , b Images MET haute résolution d'un Cu2 O NP et un Ag NP, respectivement
La figure 5a est un diagramme de diffraction des rayons X de ZnO NR tels que cultivés. Les pics forts coïncident avec les pics caractéristiques du ZnO, qui confirment la bonne cristallinité des NR. La figure 5b est un diagramme de diffraction des rayons X de Cu2 O/ZnO NR. Il est similaire à la Fig. 5a, et aux pics de diffraction de Cu2 O ne peut pas être observé. Cela peut être raisonnablement attribué à la petite quantité de NP sur la surface NR comme on peut le voir sur la figure 3a. La figure 5b confirme également que la cristallinité du ZnO est préservée après le processus de photoréduction. La figure 5c montre la spectroscopie de photoémission aux rayons X (XPS) du Cu2 O/ZnO NR. Les pics correspondant à Cu + est clairement visible, ce qui confirme la formation de Cu2 O NPs. Il y a aussi des pics correspondant à Cu 2+ avec une intensité plus faible, ce qui est probablement dû au CuSO4 résiduel ou formation de CuO NPs.
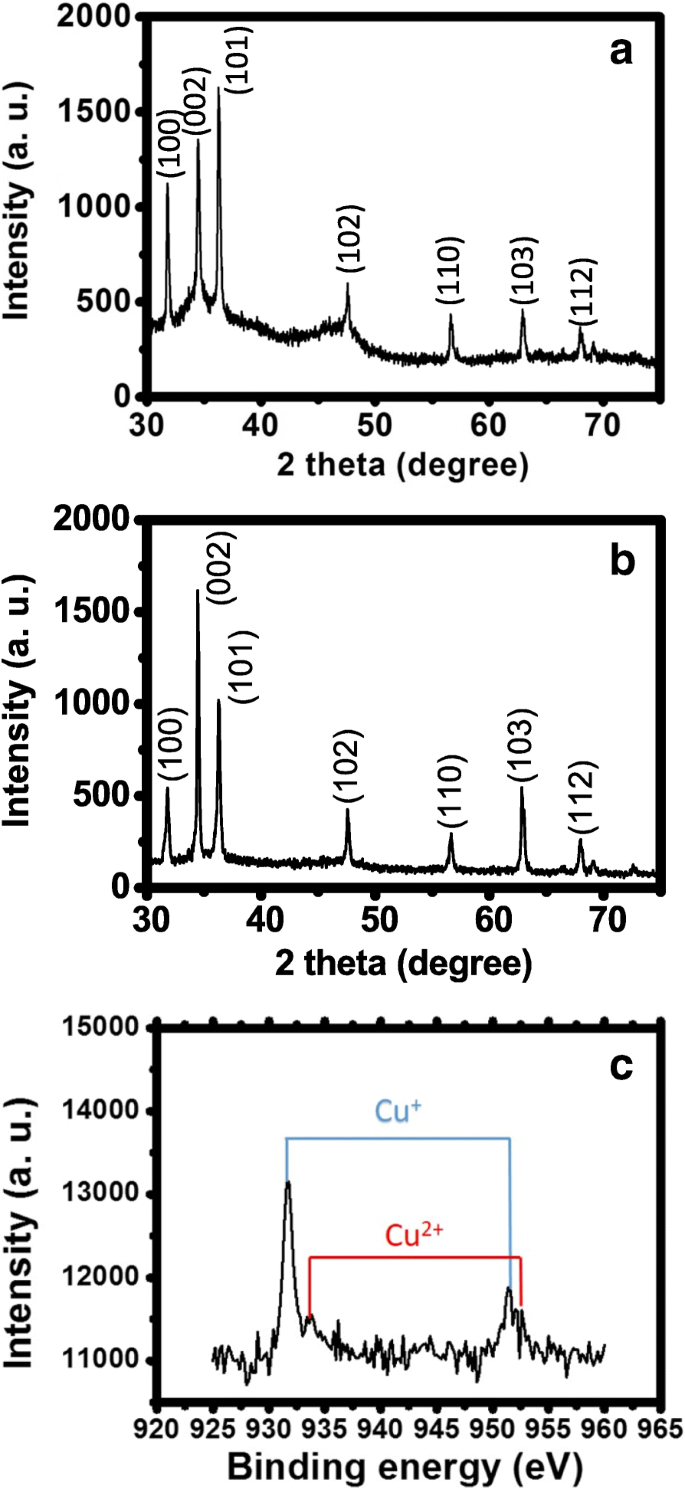
un , b Diagrammes de diffraction des rayons X du ZnO et du Cu2 cultivés O/ZnO NR. c Un spectre XPS de Cu2 O/ZnO NR
La figure 6 montre les spectres de photoluminescence (PL) des quatre papiers photocatalytiques. Les spectres présentent un fort pic d'émission de bande interdite à environ 400 nm et un pic plus petit à environ 470 nm, qui est lié à un défaut d'émission des lacunes d'oxygène [22]. Les intensités PL des trois papiers ZnO NR décorés NP sont inférieures à celles du papier ZnO NR. Ceci est principalement dû à deux effets. Le premier est l'amélioration de la séparation des charges après l'ajout de NP, ce qui réduit la recombinaison des électrons et des trous photogénérés. La seconde est l'absorption de la lumière émise par les NPs. Le papier Ag/ZnO a une intensité PL plus faible que le Cu2 Papier O/ZnO. Le travail de sortie du cristal Ag est d'environ 4,5 ~ 4,7 eV et une jonction Schottky se forme entre Ag et ZnO [9]. La jonction est efficace pour la séparation des charges, et par conséquent, l'intensité PL du papier Ag/ZnO est donc plus faible. De plus, l'intensité PL de l'Ag/Cu2 Le papier O/ZnO est le plus petit, ce qui est attendu car il a deux types de NP et en conséquence la meilleure séparation de charge.
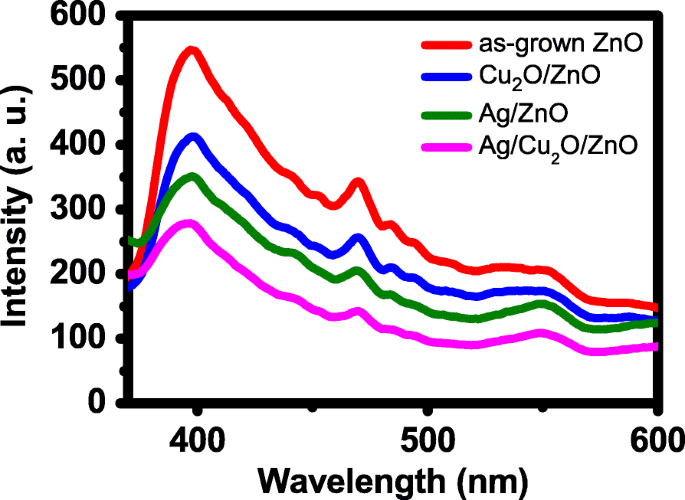
Spectres PL des quatre papiers photocatalytiques
Les spectres d'absorption de la solution de RhB en fonction du temps (à 10 min d'intervalle) résultant de la photocatalyse du ZnO et Ag/Cu2 Les papiers O/ZnO sous l'éclairage d'une lampe halogène sont représentés sur les figures 7 a et b, respectivement. À 80 min, les concentrations résiduelles de RhB sont respectivement d'environ 35 % et 16 % de la valeur d'origine. Les rapports de la concentration C t à la concentration initiale C 0 en fonction du temps pour les quatre papiers photocatalytiques sont tracés dans une échelle logarithmique sur la figure 7c. Les résultats de la photodégradation peuvent être ajustés à l'équation cinétique du premier ordre C t = C 0 exp(−kt ), où t est l'heure et k la constante du premier ordre. En utilisant l'ajustement linéaire des moindres carrés, les constantes ajustées sont 0,013, 0,016, 0,019 et 0,022 min −1 pour ZnO, Cu2 O/ZnO, Ag/ZnO et Ag/Cu2 Papiers O/ZnO, respectivement.
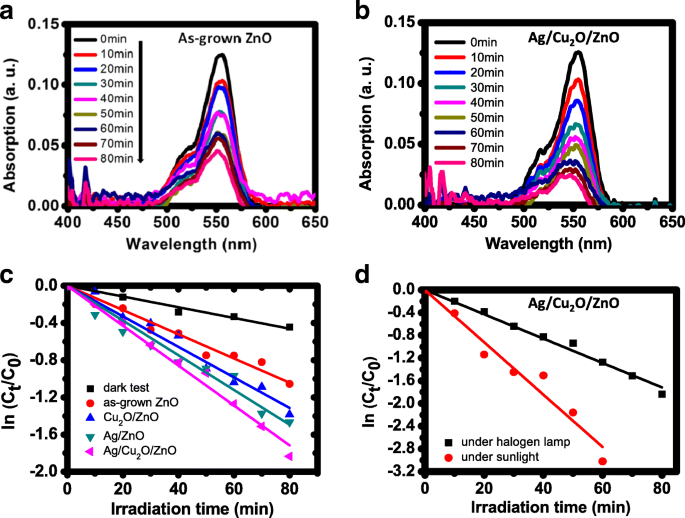
un , b Spectres d'absorption de la solution de RhB en fonction du temps (à 10 min d'intervalle) résultant de la photocatalyse du ZnO et de l'Ag/Cu2 papiers O/ZnO, respectivement. c Parcelles de ln(C t /C 0 ) pour le papier ZnO à l'obscurité et les quatre papiers photocatalytiques à la lumière. d Parcelles de ln(C t /C 0 ) pour l'Ag/Cu2 Papier O/ZnO sous l'éclairage d'une lampe halogène et en plein soleil
Une partie de la dégradation mesurée du colorant est due à l'absorption du colorant par le papier. Le changement de concentration causé par le papier ZnO dans l'obscurité est également illustré à la Fig. 7c, et la constante cinétique est de 0,005 min −1 . Après avoir soustrait la constante d'absorption des constantes mesurées, les constantes cinétiques de photodégradation corrigées sont de 0,008, 0,011, 0,014 et 0,017 min −1 pour les quatre papiers photocatalytiques. En effet, l'Ag/Cu2 Le papier O/ZnO présente la meilleure efficacité et les améliorations de la constante cinétique par rapport aux trois autres papiers sont respectivement d'environ 113 %, 55 % et 21 %. L'Ag/Cu2 Le papier O/ZnO (le même que celui utilisé auparavant) a également été testé à la lumière directe du soleil. (L'emplacement du test était à 120,99° E et 24,79° N. La date du test était à midi en juillet avec une température d'environ 32°C. L'intensité lumineuse était d'environ 1,0 AM.) Les résultats sont représentés sur la Fig. 7d avec les résultats de la lampe halogène pour comparaison. La constante cinétique ajustée est de 0,041 min −1 (après exclusion de l'effet d'absorption physique), et la valeur est d'environ 2,4 fois la constante cinétique obtenue en utilisant la lampe halogène.
Dans l'image MET montrée sur la figure 3a, il n'y a que peu de Cu2 O et Ag NPs sur un ZnO NR. La quantité de NP peut être facilement augmentée en utilisant un temps de photoréduction plus long. Les images SEM de Ag/ZnO NRs avec différents temps de réduction de 1, 1,5, 2 et 2 min sont montrées sur la Fig. 8. Sur la Fig. 8a, il n'y a que quelques Ag NPs sur les ZnO NRs au temps de réduction de 1 min. La quantité d'Ag NPs augmente rapidement lorsque le temps de réduction est légèrement augmenté à 1,5 min, comme le montre la figure 8b. Finalement, les NR de ZnO sont recouverts de NP d'Ag lorsque le temps de réduction est augmenté à 2 min, comme le montre la figure 8d. En conséquence, le temps de photoréduction peut être utilisé comme un paramètre efficace pour contrôler la quantité d'Ag NPs.

a–d Images SEM de NR Ag/ZnO avec des temps de photoréduction de 1, 1,5, 2 et 2,5 min, respectivement
Sur la figure 7c, le papier Ag/ZnO montre une meilleure efficacité que le Cu2 Papier O/ZnO. Ceci est cohérent avec le résultat PL montré sur la figure 6, qui indique que le papier Ag/ZnO a une intensité PL plus faible et donc une meilleure séparation des charges. Cependant, cela peut aussi s'expliquer en considérant la bande d'énergie de Cu2 O. Les radicaux hydroxyles sont responsables de la dégradation des colorants et générés par l'oxydation des ions hydroxyde par l'intermédiaire de l'Eq. (1) ou des molécules d'eau par l'intermédiaire de l'Eq. (2). Les diagrammes de bandes d'énergie de ZnO et Cu2 O et les potentiels de réduction standard pour les deux réactions sont montrés dans la Fig. 9. Les fonctions de travail de ZnO et Cu2 O sont respectivement de 4,3 et 3,2 eV, et les énergies de bande interdite sont respectivement de 3,2 et 2,1 eV. Les potentiels de réduction standard (par rapport à l'électrode à hydrogène standard (SHE), qui est de 4,44 V en dessous du niveau de vide) sont E o ( • OH/OH − ) = 2.02 V et E o ( • OH/H2 O) = 2,72 V, respectivement. Par conséquent, des trous photogénérés dans Cu2 O n'ont pas assez d'énergie pour participer aux deux réactions ci-dessus. D'autre part, les Ag NP améliorent l'absorption de la défection de la lumière visible dans le ZnO et les trous photogénérés dans le ZnO ont suffisamment d'énergie pour produire des radicaux hydroxyles. En conséquence, le papier Ag/ZnO montre une meilleure efficacité que le Cu2 Papier O/ZnO.
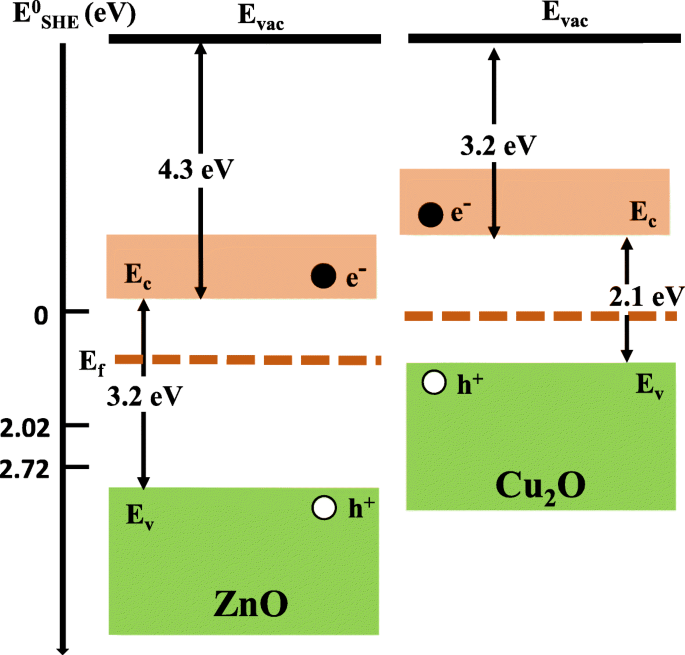
Les diagrammes de bandes d'énergie de ZnO et Cu2 O et les potentiels de réduction standard pour les équations. (1) et (2). Le potentiel de réduction est relatif à SHE, qui est de 4,44 eV en dessous du niveau de vide
Le tableau 1 montre une comparaison des performances de l'Ag/Cu2 Papier O/ZnO avec des NR de ZnO décorés par NP et supportés par un substrat récemment rapportés pour la photodégradation de la solution de RhB. Bien que les conditions expérimentales dans ces travaux diffèrent considérablement, l'efficacité raisonnable du papier photocatalytique est évidente. Compte tenu des avantages de la flexibilité, de la légèreté, de la non-toxicité, du faible coût et de la facilité de fabrication et de mise à l'échelle, le présent papier photocatalytique présente également un bon potentiel de dégradation efficace des polluants de colorants organiques et d'autres applications photocatalytiques.
Conclusions
Dans cette étude, la fabrication de papier photocatalytique composé de Cu2 Des NR de ZnO décorés à l'O et à l'Ag NP sont rapportés. Les ZnO NR sont cultivés sur un substrat de papier kraft en utilisant une méthode hydrothermale, suivi d'une décoration avec Cu2 O, Ag ou les deux NP utilisant des processus de photoréduction. Les analyses SEM et diffraction des rayons X confirment que les NR possèdent une bonne cristallinité. L'analyse MET confirme les compositions des deux types de NP. Quatre types différents de papiers photocatalytiques d'un format de 10 × 10 cm 2 sont préparés et utilisés pour la photodégradation de la solution de RhB (10 μM et 100 mL). Sous l'éclairage d'une lampe halogène de 300 W, les constantes cinétiques du premier ordre pour le ZnO et Ag/Cu2 Les papiers O/ZnO sont 0,008 et 0,017 min −1 , respectivement. Sous la lumière directe du soleil, l'Ag/Cu2 Le papier O/ZnO atteint une constante cinétique de 0,041 min −1 . Les performances de l'Ag/Cu2 Le papier photocatalytique O/ZnO se compare bien aux autres photocatalyseurs nanocomposites ZnO supportés par un substrat. Avec les avantages de la flexibilité, du poids léger, de la non-toxicité, du faible coût, de la facilité de fabrication et d'une efficacité raisonnable, le papier photocatalytique a un bon potentiel pour réduire la pollution par les colorants organiques et d'autres applications photocatalytiques à lumière visible.
Disponibilité des données et des matériaux
Les ensembles de données utilisés et/ou analysés au cours de la présente étude sont disponibles auprès de l'auteur correspondant sur demande raisonnable.
Abréviations
- EDS :
-
Spectroscopie à dispersion d'énergie
- JCPDS :
-
Comité mixte sur les normes de diffraction des poudres
- NP :
-
Nanoparticule
- NR :
-
Nanotige
- PL :
-
Photoluminescence
- RhB :
-
Rhodamine B
- SEM :
-
Microscopie électronique à balayage
- ELLE :
-
Électrode à hydrogène standard
- TEM :
-
Microscopie électronique à transmission
- UV :
-
Ultraviolet
- XPS :
-
Spectroscopie de photoémission aux rayons X
Nanomatériaux
- Démonstration d'un biocapteur flexible à base de graphène pour la détection sensible et rapide des cellules cancéreuses de l'ovaire
- États électroniques de nanocristaux dopés à l'oxygène et émission visible sur silicium noir préparés par ns-Laser
- Synthèse hydrothermale de nanoparticules d'In2O3 jumelles hybrides disque hexagonal hétérostructures ZnO pour des activités photocatalytiques et une stabilité améliorées
- Performances photocatalytiques induites par la lumière visible des nanocomposites ZnO/g-C3N4 dopés N
- Nanotubes de titane préparés par anodisation rapide pour la décoloration photocatalytique de colorants organiques sous UV et lumière solaire naturelle
- Fabrication d'hétérostructures Hiérarchiques ZnO@NiO Core–Shell pour de meilleures performances photocatalytiques
- Synthèse facile et amélioration de l'activité photocatalytique en lumière visible de nouveaux composites à hétérojonction p-Ag3PO4/n-BiFeO3 pour la dégradation des colorants
- Influence du dopage au magnésium sur les nanoparticules de ZnO pour une évaluation photocatalytique améliorée et une analyse antibactérienne
- Synthèse in situ de photocatalyseurs BiOBr0.3I0.7/Ag/AgI tout solide à l'état solide avec une activité photocatalytique améliorée sous irradiation à la lumière visible



