Synthèse facile de nanoparticules d'iridium sans ligand et leur biocompatibilité in vitro
Résumé
Les nanoparticules inorganiques à haute densité se sont révélées prometteuses dans les applications médicales qui utilisent des rayonnements, notamment l'imagerie aux rayons X, et en tant qu'amplificateurs de dose de rayonnement pour la radiothérapie. Nous avons développé une méthode de synthèse aqueuse pour produire de petites (~ 2 nm) nanoparticules d'iridium (IrNP) par réduction du chlorure d'iridium (III) à l'aide d'un agent réducteur de borohydrure. Contrairement à d'autres méthodes de synthèse basées sur des solutions, les IrNP uniformes et monodispersées sont produites sans l'utilisation de tensioactifs ou d'autres ligands solubilisants. Ces nanoparticules sont hautement cristallines comme observé par diffraction des rayons X et microscopie électronique à transmission (MET) à haute résolution. Des tests de toxicité métabolique in vitro utilisant des cellules d'hépatocytes et de macrophages démontrent que les IrNP et le chlorure d'iridium (III) sont bien tolérés à des concentrations allant jusqu'à 10 μM d'iridium. De plus, les IrNP ont été évaluées dans un test hémolytique et se sont avérées n'avoir aucun impact significatif sur les globules rouges lorsqu'elles sont exposées à des concentrations allant jusqu'à 100 μM. Dans l'ensemble, ces résultats soutiennent le potentiel d'application in vivo de ce nanomatériau.
Contexte
Les nanoparticules de métaux nobles sont un pilier des nanotechnologies émergentes en raison de leurs intéressantes propriétés optiques, électroniques et catalytiques de surface. En nanomédecine, ces biomatériaux uniques ont attiré une attention considérable en raison de leur capacité à adapter leurs interactions biologiques grâce à des modifications de surface pour un large éventail d'applications [1]. Les nanoparticules d'or (AuNP) ont fait l'objet d'études approfondies pour des applications de détection et thérapeutiques [2, 3], tandis que d'autres métaux nobles, dont l'argent, ont trouvé des utilisations de niche telles que les antimicrobiens [4]. Cependant, les nanoparticules composées d'éléments platinoïdes, qui sont couramment utilisées pour leurs propriétés catalytiques de surface [5], doivent encore être examinées en profondeur pour des applications biomédicales. La stabilité de surface exceptionnelle et la compatibilité biologique connue de ces éléments, ainsi que leurs nouvelles propriétés physiques potentielles à l'échelle nanométrique, en font des alternatives uniques aux AuNP.
Le rayonnement à haute énergie est largement utilisé en médecine, notamment en imagerie diagnostique et en radiothérapie. Par conséquent, les matériaux fonctionnels qui interagissent avec le rayonnement, tels que les nanoparticules à numéro atomique élevé et à haute densité, peuvent améliorer les performances de ces modalités. La majorité des études chimiques et d'ingénierie à ce jour se sont concentrées sur les AuNP pour améliorer les interactions avec les rayonnements, bien que le bismuth et le hafnium aient été examinés respectivement pour des applications diagnostiques et thérapeutiques [6, 7].
Ici, nous présentons une méthode synthétique pour produire des nanoparticules d'iridium (IrNP), qui devraient avoir une forte atténuation du rayonnement en raison de sa densité élevée. L'iridium est l'un des métaux les moins réactifs, considéré comme généralement biologiquement compatible, et a une densité élémentaire de 22,56 g/cm 3 (derrière seulement l'osmium, qui est connu pour être très toxique). Un isotope de l'iridium, 192 L'Ir est un émetteur gamma de curiethérapie couramment utilisé, et une partie du succès de ce matériau est due à la densité élevée, c'est-à-dire au grand nombre d'atomes dans un petit volume du matériau. Dans la présente étude, nous présentons la synthèse des IrNPs et leur biocompatibilité in vitro ainsi que celle des ions iridium, qui n'a pas encore été évaluée dans les lignées cellulaires sélectionnées. Ces nouveaux IrNP n'ont pas été facilement explorés à des fins médicales malgré l'inertie chimique et la densité supérieure du matériau. Bien que l'iridium soit un matériau relativement cher comme d'autres métaux nobles, sa valeur actuelle en tant que matière première est environ les trois quarts du prix de l'or et la moitié de celui du rhodium, ce qui en fait une alternative économique intéressante.
Méthodes
Synthèse des IrNP
Toutes les réactions de synthèse ont été réalisées à température ambiante dans des conditions aérobies dans de l'eau purifiée 18 MΩ. Un stock de chlorure d'iridium (III) 20 mM (Acros Organics) a été préparé par sonication dans un bain et agité pendant au moins 20 minutes pour générer une solution optiquement claire. Une solution de 1,0 M de borane morpholine (Alfa Aesar) a également été préparée par sonication en bain. Pour des synthèses à plus grande échelle d'un volume total de 500 ml, 25 ml de solution de chlorure d'iridium (III) ont été utilisés (dilué à 1,0 mM) et 5,0 ml de borane morpholine ont été ajoutés (concentration finale de 10 mM) sous agitation rapide. La solution est progressivement passée du brun foncé au noir en 30 min. Les nanoparticules ont pu se stabiliser pendant au moins 60 min. Cette solution colloïdale a été directement ajoutée à des filtres à spin centrifuge (Amicon Ultra-4, cellulose régénérée 10k MWCO), et les nanoparticules ont été collectées à 4000×g et lavé à l'eau purifiée. Les nanoparticules ont ensuite été mises en suspension dans de l'eau, passées à travers un filtre seringue (Millex-MP 0,22 μm EO) et stockées pour quantification.
Caractérisation des nanoparticules
Pour l'analyse par spectroscopie photoélectronique aux rayons X (XPS), les nanoparticules ont été mises en suspension dans un volume égal d'acide nitrique, collectées par centrifugation dans un tube de microcentrifugation (5 min, 17 rcf) et mises en suspension dans l'eau avant l'analyse. La microscopie électronique à transmission (MET) a été réalisée sur un MET FEI Tecnai F-20 fonctionnant à 200 kV. Les IrNP purifiées ont été coulées par goutte sur des grilles TEM supportées par du carbone troué (Ted Pella) et séchées à température ambiante pendant la nuit. L'analyse par diffraction de raies a été réalisée à l'aide du logiciel d'analyse ImageJ. Pour l'analyse par diffraction des rayons X (XRD), les IrNP concentrés ont été coulés par goutte sur une lame de verre et séchés à température ambiante. Les données XRD ont été recueillies dans une géométrie de faisceau focalisé (Bragg-Brentano) sur un système de diffraction des rayons X Rigaku Ultima IV utilisant un rayonnement Cu Kα monochromatisé en graphite. Les balayages ont été effectués sur la plage angulaire de 20 à 80° 2θ à une vitesse de balayage de 0,1°/min à température ambiante. La diffusion dynamique de la lumière (DLS) a été réalisée sur un Malvern Nano ZSP dans des cuvettes jetables en polystyrène. Les nanoparticules ont été mises en suspension dans l'eau et les données sont présentées comme distribuées par nombre. Les spectres d'absorbance UV-Vis ont été collectés sur un Tecan M200 Pro dans une plaque noire à 96 puits et un volume total de solution de 100 μL. Les concentrations d'iridium ont été ajustées pour illustrer les pics d'absorbance relative. L'analyse XPS a été réalisée sur un PHI Versaprobe II équipé d'un analyseur d'électrons hémisphérique et d'une source de rayons X en aluminium Kɑ (1486,7 eV). L'analyse du spectre a été réalisée à l'aide de la suite logicielle Multipak. L'étalonnage de l'énergie de liaison a été effectué en utilisant le pic C1s à 284,6 eV, et l'ajustement du pic était basé sur des pics asymétriques et un arrière-plan Shirley itéré, ce qui a donné une valeur du chi carré de 1,13. La spectrométrie de masse plasmatique à couplage inductif (ICP-MS) des IrNPs et une solution de chlorure d'iridium (III) ont été évaluées avant les essais de toxicité biologique. Cinquante microlitres de chaque solution d'IrNP ont été digérés dans 50 μL d'eau régale (3:1 M d'acide nitrique concentré en acide chlorhydrique) pendant une nuit à 70 °C dans un tube de digestion. Les échantillons ont ensuite été dilués dans 5,0 mL d'acide nitrique à 1 % pour analyse. L'ICP-MS a été réalisée sur un Agilent 7900 utilisant de l'hélium comme gaz de collision. Les courbes d'étalonnage ont été préparées en utilisant 100 à 0,1 μg/mL de solutions mères d'iridium (dans 1 % de HCl), et tous les échantillons ont été dilués de telle sorte que les concentrations ont été mesurées dans la plage des dizaines de ppb.
Analyse de cytotoxicité
Les lignées cellulaires HepG2 et J774A.1 ont été ensemencées à 2 × 10 5 cellules par puits (100 μL) dans une plaque à 96 puits (DMEM avec 10 % de FBS) et laissé reposer pendant 24 h. Des nanoparticules d'iridium, du sel d'iridium, de l'eau ou du DMSO ont été ajoutés à un volume de 10 % (10 μL de volume supplémentaire). Les cellules ont ensuite été incubées pendant 24 ou 48 h. Pour l'analyse de viabilité, le milieu a été retiré et les cellules ont été lavées une fois dans du PBS. Cent microlitres de milieu de culture avec 10 % de bleu Alamar (Thermo Scientific) ont été incubés avec les cellules pendant 2 h. Le milieu a ensuite été replaqué dans une plaque noire à 96 puits et la fluorescence a été lue (ex530/em590) sur un Tecan M200 Pro. Toutes les données ont été réalisées en quatre exemplaires et les expériences ont été répétées sur des jours indépendants pour confirmer les tendances générales. Un test hémolytique a été réalisé comme indiqué précédemment [8].
Résultats
Synthèse et caractérisation de nanoparticules d'iridium
Dans cette synthèse, nous formons des IrNPs élémentaires à partir de sel de chlorure d'iridium (III) par réduction avec un excès molaire 10 fois de borane morpholine dans l'eau. La réaction est facilement extensible à plusieurs litres et des particules se forment à température ambiante dans des conditions aérobies. Cette méthode synthétique produit de petites IrNP uniformes (2-3 nm) (Fig. 1a) avec un degré élevé de cristallinité, comme observé par l'imagerie MET haute résolution. Les diagrammes de diffraction obtenus à partir de MET confirment en outre l'identité des nanocristaux, avec un espacement des lignes de 0,22 nm qui indique le réseau de diffraction de l'iridium (Fig. 1b). Le diagramme de diffraction des rayons X correspond étroitement à celui de l'iridium élémentaire (PDF Card No. :9008470, Fig. 1c). Tels qu'ils sont synthétisés, les IrNP sont stables au niveau colloïdal dans l'eau et restent en suspension en solution pendant plusieurs mois à température ambiante (Fig. 1d).
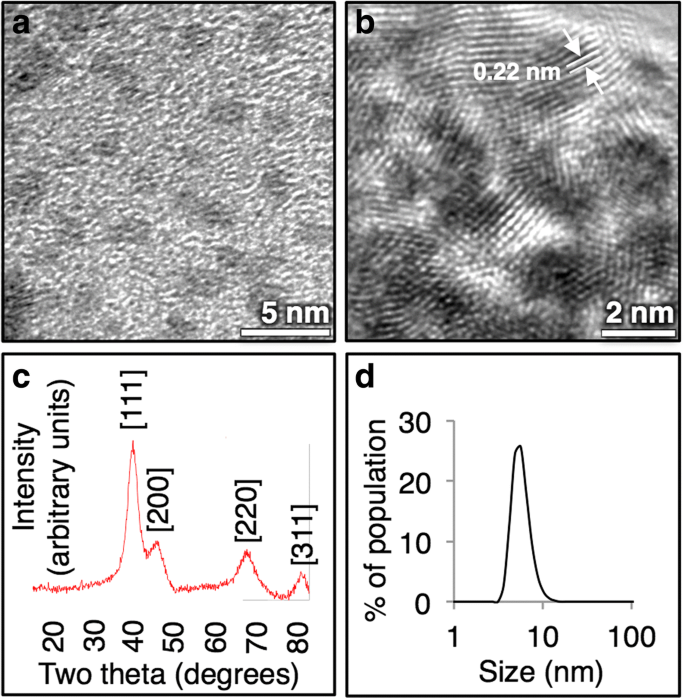
un Les nanoparticules d'iridium mesurent 2 à 3 nm par imagerie TEM, avec b avec un paramètre de maille très cristallin. c Le spectre XRD correspond à l'iridium élémentaire et d les particules ont une taille hydrodynamique de 5 nm dans l'eau par DLS
Des nanocristaux se forment en 30 minutes, comme observé par un changement de couleur du précurseur jaune clair d'iridium (III) à une solution de nanoparticules noir foncé (Fig. 2). Lorsqu'elles sont exposées à un environnement basique, ces IrNP forment un oxyde d'iridium prédit, qui apparaît en bleu. Les conditions acides, telles que l'incubation dans de l'acide nitrique pur, ne semblent pas avoir d'impact sur la cristallinité des particules ou l'intégrité du matériau ; cependant, il induit une floculation et des précipitations. En outre, une agrégation a également été observée dans des solutions biologiquement pertinentes (solution saline tamponnée au phosphate et milieux de culture tissulaire) au cours des heures, suggérant qu'une modification de surface supplémentaire sera nécessaire pour les futures applications biomédicales. L'analyse par spectroscopie photoélectronique aux rayons X des IrNP rincées dans de l'acide nitrique et en suspension dans l'eau révèle une surface prédominante d'iridium (0), bien que l'analyse d'ajustement des pics des données indique une oxydation de surface de 20 % (Fig. 3). Aucune orientation de cristallite préférée des particules n'est observée, que ce soit par XRD ou par XPS. Alternativement, l'introduction d'un tensioactif thiol dans la solution réactionnelle pendant le processus de synthèse (avant la nucléation) a entraîné l'inhibition de la formation de particules.
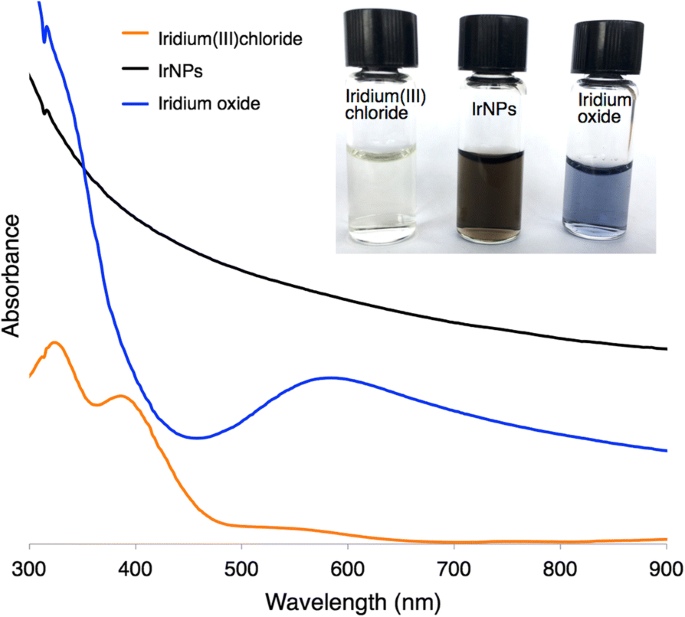
Le chlorure d'iridium (III) apparaît jaune pâle avec des pics d'absorbance à 324 et 386 nm. Les IrNP sont des absorbeurs à large spectre et apparaissent en noir. L'oxyde d'iridium (prévu), produit à partir d'IrNP oxydées traitées dans une solution basique, apparaît bleu-violet avec un pic d'absorbance à 584 nm
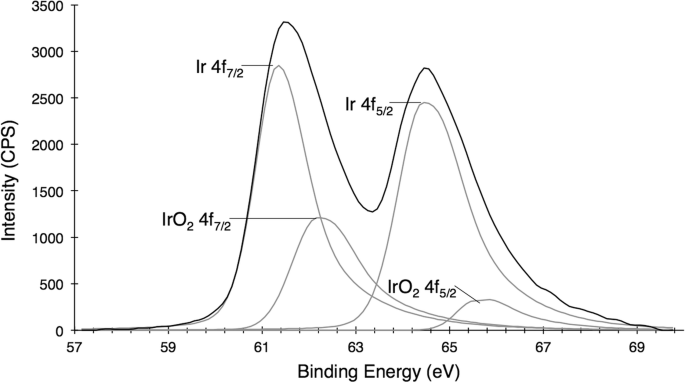
Spectroscopie photoélectronique aux rayons X (XPS) des IrNPs, un état de surface à prédominance d'iridium élémentaire, avec environ 20 % de contamination de surface par les oxydes
Cytotoxicité de l'iridium
Nous avons évalué la compatibilité biologique in vitro des IrNPs non coiffées et l'avons comparée au sel de chlorure d'iridium (III) dans deux types de cellules de mammifères. HepG2, une lignée cellulaire de carcinome hépatocytaire, a été utilisée pour évaluer la toxicité potentielle pour le foie. Des cellules de macrophage J774A.1 ont été utilisées pour évaluer la toxicité pour le système phagocytaire mononucléaire. Les cellules ont été incubées avec des IrNP ou du chlorure d'iridium (III) (normalisé pour la concentration totale d'iridium) pendant 24 ou 48 h et lavées pour éliminer l'iridium extracellulaire, et l'activité métabolique a été évaluée à l'aide du test Alamar Blue (Fig. 4). Les cellules HepG2 présentent une activité métabolique accrue en présence d'iridium (III) à 24 h (jusqu'à 115 % de viabilité), mais la réponse est atténuée à 48 h, avec 500 μM d'iridium (III) réduisant la viabilité à 90 %. Les cellules HepG2 avaient une viabilité cellulaire réduite, de 94 à 78% en présence de 50 μM d'IrNP à 24 et 48 h. Fait intéressant, les cellules J774A.1 montrent une augmentation de l'activité métabolique en réponse aux IrNP à une concentration de 50 μM avec une viabilité de 122 % à 24 h ; Cependant, après 48 h, la fonction cellulaire normale a repris (98 % de viabilité), suggérant une stimulation métabolique transitoire en réponse aux nanomatériaux. Les cellules J774A.1 incubées avec 500 μM d'IrNP pendant 24 h présentent une réponse métabolique apparemment neutre, mais la diminution de la viabilité à cette concentration après 48 h suggère qu'il s'agit d'un résultat de la toxicité et de la stimulation métabolique qui apparaît comme une réponse de viabilité neutre. De plus, nous avons évalué la biocompatibilité in vitro des IrNP avec le sang par un test hémolytique et avons trouvé que les IrNP n'induisaient aucune hémolyse significative lorsqu'elles étaient incubées avec des érythrocytes dans du PBS à 37 °C pendant 1 h (Fichier supplémentaire 1 :Figure S1).
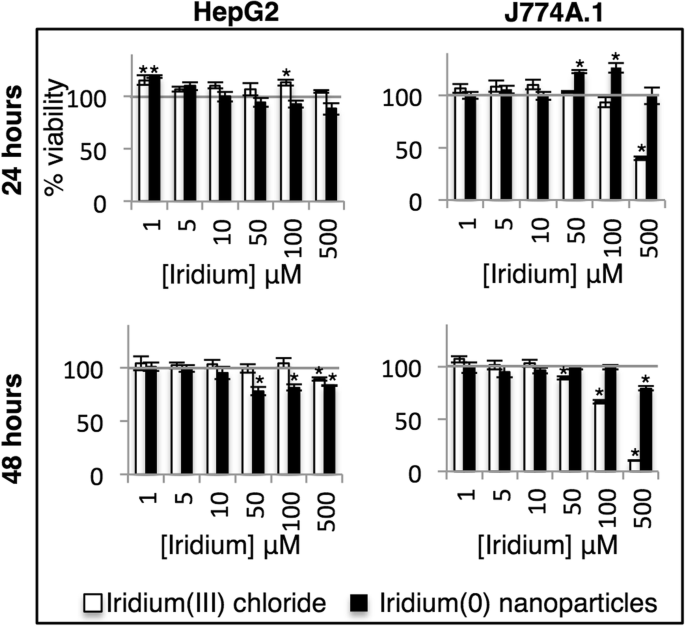
Viabilité cellulaire des cellules HepG2 et J774A.1 incubées avec des nanoparticules d'Ir(0) ou du sel d'Ir(III) pendant 24 ou 48 h. *Valeurs statistiquement significatives (p < 0,05) par rapport aux cellules non traitées
Discussion
Divers procédés de synthèse ont été examinés pour produire de l'iridium à l'échelle nanométrique pour des applications catalytiques, notamment la réduction des sels d'iridium par les hydrures et l'hydrogène gazeux [9,10,11,12,13], les rayons UV et gamma [14,15,16,17], et la réduction du polyol ou de l'alcool [18,19,20]. Cependant, bon nombre de ces méthodes de synthèse sont conçues pour l'intégration de l'iridium sur un substrat ou un support pour des réactions chimiques et ne sont pas compatibles avec les applications biologiques [21]. Récemment, aérosolisé 192 L'Ir a été utilisé comme matériau modèle à l'échelle nanométrique pour la toxicité pulmonaire et a été choisi pour son inertie exceptionnelle [22, 23]. L'objectif principal de ces études était d'examiner la clairance et la translocation des particules fines inhalées des poumons; cependant, il met également en évidence la biocompatibilité de cet élément.
Nous avons évalué la compatibilité biologique in vitro des IrNP non coiffées et l'avons comparée au sel de chlorure d'iridium (III) dans deux types de cellules de mammifères qui devraient accumuler les concentrations les plus élevées de nanoparticules injectées. La toxicité de l'iridium (III) dans les cellules J774A.1 suit une courbe dose-réponse de toxicité normale ; 100 μM d'iridium (III) réduit la viabilité cellulaire à 93 et 66 %, et 500 μM entraînent une viabilité cellulaire de 40 et 10 % à 24 et 48 h respectivement. Ces données reflètent une réponse cellulaire intéressante à l'iridium (0) et à l'iridium (III), et nous prévoyons d'explorer davantage ces effets in vivo. On s'attend à ce que des IrNP plus petites et d'autres nanomatériaux inorganiques peu solubles soient transloqués vers les reins et le foie, avec une résidence temporelle courte dans les reins et une résidence plus longue dans le foie, ce qui pourrait avoir un impact supplémentaire sur les profils de toxicité spécifiques aux cellules. L'excrétion est attendue par les fèces pour les particules d'iridium plus grosses, bien que nous nous attendions à ce que la taille extrêmement petite de ces IrNPs puisse être facilement filtrée à travers le système rénal si la stabilité colloïdale in vivo peut être maintenue [23].
En préparation pour les applications in vivo, la compatibilité sanguine des IrNPs a été évaluée par un test hémolytique. En utilisant du sang entier de souris, nous avons évalué l'effet de ces IrNP sur la rupture des érythrocytes et la libération potentielle d'hémoglobine. Bien que des études approfondies de l'IrNP modifié en surface finale devront être évaluées, les éléments constitutifs actuels de l'IrNP ne provoquent pas de réponse hémolytique détectable avant des concentrations extrêmement élevées (500 μM).
Conclusions
Nous concluons de ces études que les nanocristaux d'iridium (0) peuvent être facilement synthétisés par une simple réduction au borohydrure aqueux de chlorure d'iridium (III), ce qui donne des nanoparticules hautement cristallines de 2 à 3 nm qui sont colloïdalement stables dans l'eau avec une hydrodynamique d'environ 5 nm. Taille. Lors d'une exposition aiguë, ces particules sont non toxiques à des concentrations allant jusqu'à 50 μM d'iridium (contre 10 μM pour le chlorure d'iridium) dans les hépatocytes, stimulent l'activité métabolique dans les cellules macrophages et ne provoquent pas de réponse hémolytique à des concentrations pratiques. Ces nanoparticules sans ligand peuvent servir de blocs de construction ou de noyaux pour les IrNPs modifiées en surface ultérieures pour une utilisation dans des applications biologiques et médicales. Une étude plus approfondie des propriétés fonctionnelles de ces nanomatériaux à haute densité en présence de rayons X ou d'autres rayonnements offre la possibilité de nouveaux agents thérapeutiques et diagnostiques.
Abréviations
- AuNP :
-
Nanoparticule d'or
- DLS :
-
Diffusion dynamique de la lumière
- ICP-MS :
-
Spectrométrie de masse à plasma à couplage inductif
- IrNP :
-
Nanoparticule d'iridium
- PDF :
-
Fichier de diffraction des poudres
- UV :
-
Ultraviolet
- XPS :
-
Spectroscopie photoélectronique aux rayons X
- XRD :
-
Diffraction des rayons X
Nanomatériaux
- Nanoparticules d'or multifonctionnelles pour des applications diagnostiques et thérapeutiques améliorées :une revue
- Synthèse facile et propriétés optiques de petits nanocristaux et nanotiges de sélénium
- Synthèse facile de composite CuSCN coloré et conducteur revêtu de nanoparticules CuS
- Étude in vitro de l'influence des nanoparticules Au sur les lignées cellulaires HT29 et SPEV
- Propriétés de synthèse et de luminescence des nanoparticules hydrosolubles α-NaGdF4/β-NaYF4:Yb,Er Core–Shell
- Synthèse et performances in vitro de nanoparticules de fer-platine revêtues de polypyrrole pour la thérapie photothermique et l'imagerie photoacoustique
- Synthèse de points quantiques de sulfure d'antimoine solubles dans l'eau et de leurs propriétés photoélectriques
- Effet de la méthode de synthèse des nanoparticules de manganite La1 − xSr x MnO3 sur leurs propriétés
- Synthèse en un seul pot de nanoplaques Cu2ZnSnSe4 et leur activité photocatalytique induite par la lumière visible



