Nouveaux nanoparticules Au Nanostars@PEG biocompatibles pour l'imagerie CT in vivo et les propriétés de clairance rénale
Résumé
Les nanosondes deviennent rapidement des outils potentiellement transformateurs pour le diagnostic des maladies pour un large éventail d'imagerie par tomodensitométrie (TDM) in vivo. Par rapport aux agents de contraste conventionnels à l'échelle moléculaire, les nanoparticules (NP) promettent des capacités améliorées pour la détection in vivo. Dans cette étude, de nouvelles nanoparticules d'Au fonctionnalisées au polyéthylène glycol (PEG) en forme d'étoile (AuNS@PEG) avec un fort coefficient d'absorption de masse des rayons X ont été synthétisées en tant qu'agents de contraste d'imagerie CT. Les résultats expérimentaux ont révélé que les nanoparticules AuNS@PEG sont bien construites avec des tailles ultrapetites, une métabolisabilité efficace, une valeur de tomodensitométrie élevée et une biocompatibilité exceptionnelle. L'imagerie in vivo a également montré que les nanoparticules AuNS@PEG obtenues peuvent être utilisées efficacement dans l'imagerie améliorée par CT. Par conséquent, les nanoparticules d'agent de contraste synthétisé AuNS@PEG en tant que candidat potentiel peuvent être largement utilisées pour l'imagerie CT.
Contexte
La dernière décennie a été témoin du développement rapide des nanoparticules en nano-biotechnologie, en raison de la diversité de leurs matériaux constitutifs et de leur grande surface [1, 2]. Parmi ces nanoparticules, Au a de nombreuses applications comme son excellente biocompatibilité et son affinité dans le domaine biomédical [3, 4]. Ces dernières années, les nanoparticules d'Au sont largement utilisées dans l'imagerie CT, en raison de leur plus grand nombre atomique, de leur métal précieux et de leur inertie chimique, ainsi que de la réaction difficile des protéines dans la réaction corporelle [5,6,7].
L'imagerie par tomodensitométrie est un outil de diagnostic clinique non invasif grâce à différentes densités et épaisseurs de différents tissus ou organes de l'atténuation du générateur de rayons X à des degrés divers, pour former différentes distributions de tissus ou d'organes de contraste d'image en niveaux de gris, et donc à la position relative de la lésion et la taille de la forme changent [8,9,10,11]. Actuellement, l'application clinique des agents de contraste CT contient principalement un composé d'iode qui est une petite molécule comprenant de l'iode organique et des composés à petites molécules d'iode inorganique, tels que le diaztrizoate (acide diatrizoïque (DTA)) et l'iohexol (Omnipaque) [12]. Cependant, le petit agent de contraste moléculaire à base d'iode éliminant les effets des composés contenant de l'iode ne nécessite qu'un temps d'imagerie très court et il n'a pas une faible toxicité rénale [13, 14]. En pratique clinique, une altération de la fonction rénale est une complication des produits de contraste iodés [15]. Par conséquent, le développement de nano-matériaux fournit de nouvelles idées et méthodes pour résoudre ces problèmes. Des études récentes ont également confirmé que l'agent de contraste CT à base de nanoparticules peut prolonger efficacement le temps d'imagerie, affaiblir la toxicité rénale et avoir une meilleure atténuation des rayons X que les agents de contraste à base d'iode, tels que les nanoparticules d'or et les particules de nano-argent utilisées comme Les agents de contraste CT ont attiré l'attention des chercheurs [16,17,18]. La nano-plate-forme de dendrimère, non seulement en tant que petite molécule modifiée de produit de contraste iodé, mais également en tant que package de modèle et stabilité de différentes nanoparticules inorganiques, améliore le temps de circulation sanguine de l'agent de contraste, ce qui le rend meilleur pour l'imagerie CT [19].
Dans cette étude, nous avons préparé les nanoparticules Au nanostar fonctionnalisées par PEG (AuNS@PEG); en raison de la plus grande surface spécifique par rapport aux nanoparticules d'Au normales de la même taille, Au nanostar pourrait grandement améliorer l'imagerie CT. Après fonctionnalisées avec du PEG, les nanoparticules Au nanostar pourraient améliorer leurs propriétés biocompatibles et de clairance rénale. Diverses méthodes, notamment TEM, EDX, XPS, MTT et cytométrie en flux, ont été utilisées pour déterminer les caractères et la biocompatibilité des nanoparticules AuNS@PEG. De plus, des analyses histologiques et des études hématologiques ont été utilisées pour des tests sur la toxicité des nanoparticules AuNS@PEG in vivo, et les résultats ont confirmé la belle biocompatible des nanoparticules AuNS@PEG. De plus, des expériences d'imagerie CT in vitro et in vivo ont également montré les excellentes capacités d'imagerie CT des nanoparticules AuNS@PEG. Tous ces résultats ont révélé que les nanoparticules d'agent de contraste AuNS@PEG synthétisées en tant que candidat potentiel pourraient être largement utilisées pour l'imagerie CT et avaient de bonnes propriétés de clairance rénale.
Méthodes
Tous les protocoles expérimentaux, y compris tous les détails pertinents, ont été approuvés par le comité d'éthique régional, Université médicale de Jinzhou, province du Liaoning, Chine.
Matériaux et instruments
Tous les produits chimiques ont été achetés auprès de Sigma-Aldrich (St. Louis, MO) et utilisés directement, sauf indication contraire.
Les nanoparticules synthétisées ont été caractérisées par microscopie électronique à transmission (MET) et analyses par rayons X à dispersion d'énergie (EDX) en utilisant une tension d'accélération de 200 kV (Tecnai G2 Twin, FEI, Hillsboro, OR). L'échantillon MET a été préparé en séchant des solutions de nanoparticules diluées sur une grille de cuivre revêtue de formvar/carbone. Les échantillons ont été préparés en déposant une goutte d'une solution colloïdale diluée sur une grille de carbone et en laissant sécher le liquide à l'air à température ambiante. Les spectres d'adsorption UV-vis ont été enregistrés sur un spectrophotomètre Shimadzu UV-2450 UV/Vis/NIR. La mesure de diffusion dynamique de la lumière (DLS) a été réalisée sur un Malvern Zetasizer NANO ZS à 25 °C.
Synthèse de nanoparticules Au Nanostars/PEG (AuNS@PEG)
Les nanoétoiles Au (Au NS) ont été synthétisées via une méthode de croissance médiée par des graines selon un rapport précédent [20,21,22] avec quelques légers ajustements. Typiquement, les graines d'Au qui se sont formées avec un diamètre de 10 nm ont été synthétisées par la réduction chimique de HAuCl4 selon le rapport précédent [23]; 6 ml de HAuCl4 solution (w /v 1%) a été ajouté à 140 ml d'eau ultrapure et chauffé à ébullition tout en agitant. Ensuite, 0,75 ml d'oléylamine a été rapidement injecté et le mélange résultant a été bouilli pendant 2 h supplémentaires. Le colloïde Au a été naturellement refroidi à température ambiante; 60 ml de cyclohexane ont été ajoutés au colloïde et la solution a été agitée magnétiquement pendant encore 1 h. Par la suite, 1,5 ml de NaOH (4 M) a été injecté dans le mélange tout en agitant vigoureusement pendant 30 minutes supplémentaires. Le mélange a été laissé pour être hiérarchique. La nanograine d'Au contenue dans la couche supérieure a été précipitée par ajout d'éthanol. Les précipités ont été alternativement purifiés avec de l'éthanol et de l'eau une fois de plus et dispersés dans l'eau.
Des nanoétoiles Au d'environ 50 nm de diamètre ont été synthétisées selon des travaux antérieurs en mélangeant rapidement et simultanément AgNO3 (1 ml, 3 mM) et de l'acide ascorbique (500 μl, 0,1 M) avec 100 ml d'une solution contenant 0,25 mM HAuCl4 , 1 mM de HCl et 1,5 ml de graines de nanosphères d'or. Ensuite, le polymère de polyéthylène glycol thiolé (PEG, 6 kDa) a été ajouté en grand excès pour passiver la surface des nanoparticules. La solution de mélange a été agitée en continu pendant 24 h, puis les nanoparticules AuNS@PEG obtenues ont été collectées par 3 cycles de centrifugation/redispersion dans l'eau. Les nanoparticules AuNS@PEG formées ont été redispersées dans de l'eau pour une utilisation ultérieure.
Culture cellulaire et exposition aux nanoparticules AuNS@PEG
Des cellules de névroglie ont été recueillies à partir de tissus de moelle épinière de rat. Les cellules ont été cultivées dans du milieu Eagle modifié de Dulbecco (DMEM) (Gibco, USA) additionné de 10 % de sérum de veau fœtal, 100 U par ml de pénicilline et 100 μg par ml de streptomycine à 37 °C dans un incubateur humidifié avec 5 % de CO
Animaux et traitement
Ce travail a été réalisé en stricte conformité avec les recommandations du Guide pour le soin et l'utilisation des animaux de laboratoire des National Institutes of Health. Le protocole a été approuvé par le Comité d'éthique des expérimentations animales de l'Université médicale de Jinzhou (numéro de permis :LMU-2013-368), Chine. Des rats mâles Sprague Dawley (180-200 g) ont été achetés auprès du Animal Center de l'Université médicale de Jinzhou (numéro de licence :SCXK 2009-0004). Tous les rats ont été nourris dans une pièce à température contrôlée (25,0 ± 0,2 °C) dans un laboratoire sans agent pathogène spécifique, avec une photopériode lumière/obscurité de 12 h/12 h et 50 % d'humidité. Les rats ont eu le libre accès à la nourriture et à l'eau.
Les critères d'évaluation sans cruauté sont choisis pour minimiser ou mettre fin à la douleur ou à la détresse des animaux de laboratoire via l'euthanasie, y compris les agents inhalés, les agents pharmaceutiques non inhalés et les méthodes physiques, plutôt que d'attendre leur mort comme critère d'évaluation. Dans ce travail, les rats ont été divisés en deux groupes :(1) contrôle :les rats ont été anesthésiés par injection intrapéritonéale d'une solution d'hydrate de chloral (10 % en poids), puis 800 μL de solution saline tamponnée au phosphate ont été injectés via la veine caudale. (2) Test :les rats ont été anesthésiés par injection intrapéritonéale de solution d'hydrate de chloral (10 % en poids), puis 800 μL de solution de nanoparticules AuNS@PEG (200 μg/ml) ont été injectés par la veine caudale. Pour l'étude H&E, les rats ont été sacrifiés par dislocation cervicale sans anesthésie préalable, et leurs cœurs, foies, reins, rate et intestins ont été immédiatement disséqués, stockés à - 80 °C et congelés dans de l'isopentane sur de la neige carbonique jusqu'à traité.
Test de viabilité cellulaire
Des cellules de névroglie en phase logarithmique ont été ensemencées sur une plaque à 96 puits à 1 × 10 4 cellules par puits dans 100 μl de suspension cellulaire. Une solution saline tamponnée au phosphate (PBS) a été ajoutée aux puits environnants. La plaque a été incubée à 37 °C et 5% de CO2 pendant 24 h pour permettre aux cellules d'adhérer. Les cellules ont ensuite été réparties en quatre groupes :les cellules du groupe témoin ont été incubées dans du DMEM contenant 10 % de sérum bovin foetal; dans le groupe de nanoparticules AuNS@PEG, 0, 25, 50, 100, 200, 500 ou 1000 ppm de nanoparticules AuNS@PEG ont été ajoutées au milieu de culture ; les cellules ont été observées 24 h plus tard sous un microscope à contraste de phase inversé (Leica, Heidelberger, Allemagne). Par la suite, 20 μl de MTT (Sigma, St. Louis, MO, USA) ont été ajoutés à chaque puits pendant 4 h. Le milieu a été retiré et les cellules ont été incubées avec 150 μl de diméthylsulfoxyde pendant 10 min à 37 °C. Les valeurs de densité optique (DO) ont été mesurées à 490 nm avec un lecteur de microplaques (Bio-Rad, Hercules, CA, USA).
Cytométrie en flux
Les cellules ont été incubées dans des plaques à 6 puits pendant 24 h, puis regroupées et traitées comme décrit ci-dessus. Une suspension unicellulaire a été réalisée à l'aide de trypsine et centrifugée à 300g pendant 3 minutes. Après élimination du surnageant, les cellules ont été lavées deux fois avec du PBS prérefroidi et centrifugées dans 1 ml d'annexine V (Tianjin Sungene Biotech Co, Ltd., Tianjin, Chine) pendant 10 minutes. Les cellules ont été ajustées à 10 5 /ml. La suspension cellulaire a été centrifugée et lavée trois fois avec du PBS. Des échantillons (100 μl) ont été ajoutés à des tubes Eppendorf avec 5 μl d'annexine V-APC (Tianjin Sungene Biotech Co., Ltd.) et 7-AAD (Tianjin Sungene Biotech Co, Ltd.) et mélangés. Le volume a été porté à 500 μl avec du PBS et les tubes ont été incubés à température ambiante pendant 15 min dans l'obscurité. L'apoptose a été quantifiée par cytométrie de flux (BD FACSCanto II, BD Becton Dickinson, San Jose, CA, USA). Le taux d'apoptose cellulaire a été calculé comme suit :nombre de cellules apoptotiques/nombre total de cellules × 100 %.
Imagerie CT
L'imagerie CT a été acquise à l'aide d'un scanner spiralé à 128 rangées et 64 coupes produit par General Electric Company (GE). Les paramètres d'imagerie étaient les suivants :l'épaisseur de la coupe est de 0,625; le milieu est la souris nude ; l'énergie du tube, kvp, est de 120 μA et 100 mA ; CTDIVOL est de 6,53 mGy ; et le rayon est de 4,8 cm. Tous les animaux ont été scannés dans la direction crânienne à caudale du bas de la poitrine au bassin. Les données CT ont été analysées par images et post-traitement.
Analyse histologique
Les organes ont été prélevés et fixés dans du paraformaldéhyde à 4 %, puis avec une solution de saccharose de paraformaldéhyde à 30 % une fois tous les 2 jours, sectionnés et colorés à l'hématoxyline et à l'éosine (H&E) pour un examen histologique en utilisant des techniques standard. Les coupes ont été examinées sous un microscope à contraste de phase inversé.
Évaluation de la fonction rénale
Un analyseur biochimique (université médicale de Jinzhou) a été utilisé pour évaluer BUN, Crea, β2 -MG et CO2 Dans le sang. La fonction rénale a été évaluée par les changements des taux sériques de BUN, Crea, 2 -MG et CO2 avant et après injection de nanoparticules AuNS@PEG sur rat.
Analyse statistique
Les données ont été exprimées en moyenne ± SD et ont été analysées à l'aide du logiciel GraphPad Prism 5.0 (GraphPad Software, Inc., La Jolla, CA, USA) et SPSS. Les groupes ont été comparés en utilisant une analyse de variance à un facteur et le test de différence la moins significative. P < 0,05 a été considéré comme statistiquement significatif.
Résultats et discussion
Synthèse et caractérisation des nanoparticules AuNS@PEG
Les nanomatériaux pénètrent dans le corps humain et jouent le rôle de détection. Les propriétés physiques et chimiques des nanoparticules sont d'abord considérées avant qu'elles n'entrent dans le système circulatoire [24, 25]. Comme nous le savons, il existe deux facteurs clés dans le développement de nanosondes hautes performances pour l'imagerie CT in vivo et les propriétés de clairance rénale. L'un est une fonctionnalisation de surface supplémentaire ; l'autre est le contrôle de la taille.
Une image de microscopie électronique à transmission (MET) à grande échelle (Fig. 1a) a été utilisée pour confirmer la structure des nanoparticules AuNS@PEG, ce qui montrait clairement que la structure en étoile des nanoparticules AuNS@PEG avait été préparée et que ces nanoparticules avaient les tailles idéales autour de 50 nm avec une grande uniformité. Ensuite, les éléments d'Au trouvés dans le spectre des rayons X à dispersion d'énergie (EDX) des nanoparticules AuNS@PEG prouvent également la préparation de la nanoétoile Au (Fig. 1c). De plus, la composition à la surface des nanoparticules AuNS@PEG a été davantage caractérisée par des spectres XPS, et les Au4f, C1s et O1s dérivés des nanostars Au et du PEG ont été clairement montrés sur la Fig. 1b qui confirment également la formation d'AuNS @PEG nanoparticules.
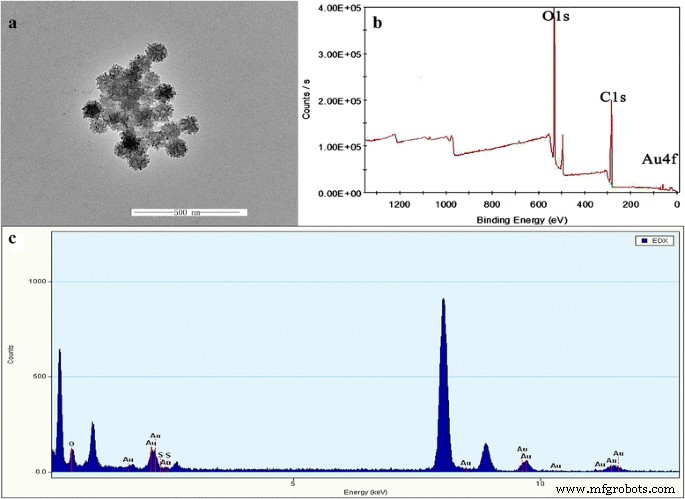
Micrographies électroniques à transmission de nanoparticules AuNS@PEG (a ), XPS (b ) et EDX (c ) des nanoparticules AuNS@PEG
Les caractéristiques ci-dessus ont démontré la synthèse réussie des nanoparticules AuNS@PEG.
CT Valeur des nanoparticules AuNS@PEG
Les nanoparticules d'Au ont été largement utilisées comme agents de contraste CT en raison de leur meilleure propriété d'atténuation des rayons X que les agents de contraste CT à petites molécules conventionnels à base d'iode. Iode (Z = 53) a historiquement été l'atome de premier choix dans le domaine de l'imagerie CT. Pour évaluer la faisabilité des nanoparticules AuNS@PEG pour l'imagerie par tomodensitométrie à rayons X, nous avons mesuré les valeurs CT (unités Hounsfield, HU). La figure 2a montre que les nanoparticules AuNS@PEG ont une valeur CT plus élevée que l'iode et l'eau DI à la même concentration. Lorsque la concentration de nanoparticules AuNS@PEG augmentait, l'intensité de l'image CT augmentait également en continu avec des images plus lumineuses. En traçant la valeur CT (en HU) de l'AuNS@PEG en fonction de la concentration (Fig. 2b), nous avons pu voir une atténuation linéaire de la valeur CT des nanoparticules AuNS@PEG avec les différentes concentrations. Ces résultats révèlent que les nanoparticules AuNS@PEG sont des candidats idéaux pour une nanosonde d'imagerie CT positive.
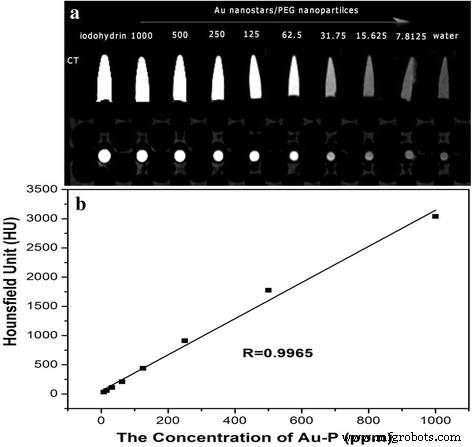
L'intensité d'atténuation des rayons X des nanoparticules AuNS@PEG en fonction de la concentration en Au (a ) et image CT des nanoparticules AuNS@PEG sous différentes concentrations (iodohydrine, 1000, 500, 250, 125, 62,5, 31,75, 15,625 et 7,8125 ppm, respectivement) (b )
Test de cytotoxicité
Il était crucial d'étudier la biocompatibilité des nanoparticules AuNS@PEG in vitro avant qu'elles ne soient utilisées en imagerie CT in vivo comme agent de contraste. Le test MTT a été réalisé pour évaluer leur cytotoxicité sur les cellules de la névroglie. Après incubation avec des nanoparticules AuNS@PEG à différentes concentrations (25, 50, 100, 200, 500 et 1000 ppm, respectivement) pendant 24 h, un test de viabilité MTT des cellules de la névroglie a été réalisé. On a pu voir que la viabilité des cellules après traitement avec des nanoparticules AuNS@PEG dans la plage de concentration étudiée est assez similaire au témoin, ce qui a clairement indiqué que les nanoparticules AuNS@PEG formées ont une bonne cytocompatibilité à une concentration jusqu'à 200 ppm . Même à une dose relativement élevée de nanoparticules (1000 ppm), la viabilité cellulaire est restée supérieure à 90 % (Fig. 3a).
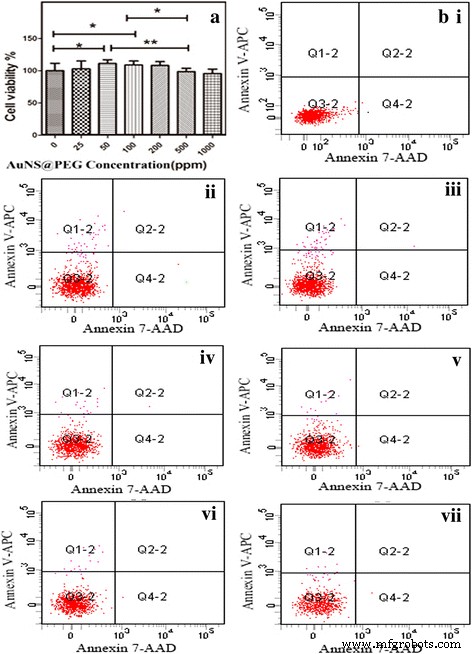
Viabilité cellulaire de la névroglie incubée avec différentes concentrations de nanoparticules AuNS@PEG pendant 24 h (a ); l'apoptose des cellules induite par les nanoparticules AuNS@PEG est montrée par cytométrie de flux :contrôle (bi ), 25 ppm (ii ), 50 ppm (iii ), 100 ppm (iv ), 200 ppm (v ), 500 ppm (vi ) et 1 000 ppm (vii )
La cytocompatibilité des nanoparticules AuNS@PEG a été confirmée par une analyse par cytométrie en flux des cellules traitées avec les nanoparticules AuNS@PEG à différentes concentrations pendant 2 h. Dans l'analyse par cytométrie en flux, les cellules ont été colorées avec de l'annexine V-APC et 7-AAD après traitement avec du PBS et des nanoparticules AuNS@PEG. Des cellules de névroglie traitées avec du PBS sans coloration ont été utilisées comme contrôle (Fig. 3bi). On a pu voir que les cellules traitées avec les nanoparticules AuNS@PEG à des concentrations de 25, 50, 100, 200, 500 et 1000 ppm, respectivement (Fig. 3bi-vii). Conjugués aux résultats du test MTT, nos résultats ont montré que les nanoparticules AuNS@PEG sont bien cytocompatibles et qu'il n'y a pas eu de changement évident de morphologie cellulaire après traitement avec les nanoparticules AuNS@PEG, ce qui correspond aux données MTT.
Imagerie CT In Vivo et Biodistribution
Encouragés par leurs performances de contraste CT élevées dans l'expérience in vitro, nous avons en outre confirmé la faisabilité des nanoparticules AuNS@PEG en tant qu'agent de contraste CT in vivo. Des nanoparticules AuNS@PEG (200 ppm) ont été injectées par voie intraveineuse dans les veines de la queue du rat. Une telle dose de nanoparticules AuNS@PEG a été choisie en raison des résultats de la faible toxicité et du pourcentage d'apoptose du MTT et de la cytométrie en flux et de la haute sensibilité de la TDM. L'imagerie CT des régions importantes des organes a été enregistrée avant l'injection dans la veine caudale et à différents moments après l'injection dans la veine caudale (Fig. 4). Notre étude vise à tester la capacité de l'imagerie CT et la clairance rénale. Nous insistons donc sur le changement de l'organe du rein et de la vessie dans l'imagerie CT. La figure 4a est l'image CT du rein de rat avant l'injection. Par rapport à la pré-injection, l'imagerie rénale est grandement améliorée de 0,5 à 2 h (Fig. 4b–d). La distribution dépendante du temps des nanoparticules AuNS@PEG chez le rat a également été suivie par la valeur du signal CT après injection intraveineuse. L'imagerie du rein et de la vessie était considérablement améliorée de 0,5 à 2 h, et leur valeur HU est passée de 95 à 464 et de 105 à 664. Après 6 h post-injection, l'intensité du contraste CT dans le rein du rat diminue évidemment avec le temps ( Figure 4e). Après 24 h post-injection, l'imagerie CT de l'organe de la vessie est complètement claire, montrant les excellentes propriétés de clairance rénale des nanoparticules AuNS@PEG (Fig. 4f). En raison de leur taille de particule optimale et de leur fonctionnalisation de surface, l'élimination des nanoparticules AuNS@PEG du sang pendant la circulation peut être si lente. Par conséquent, ces résultats indiquent que les nanoparticules AuNS@PEG telles que préparées pourraient être une nanosonde unique et prometteuse pour fournir l'imagerie CT en temps réel in vivo. Ceci est bénéfique pour les futures applications cliniques car les agents de contraste peuvent être administrés aux patients à l'hôpital.
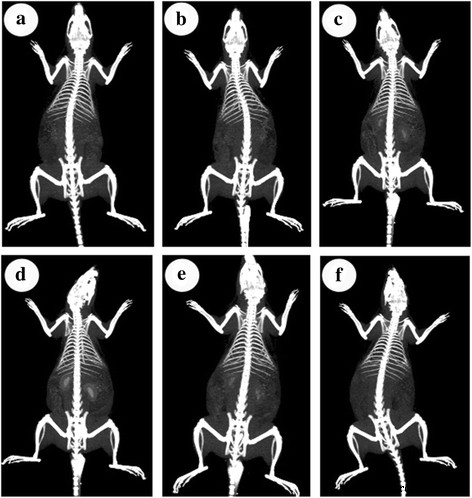
Images CT du rat avant l'injection (a ) et à différents moments (0,5, 1, 2, 6 et 24 h) (b –f ) après injection intraveineuse de nanoparticules AuNS@PEG (200 ppm)
Coloration H&E
Des changements histologiques dans les organes des souris ont été effectués après 24 h post-injection de nanoparticules AuNS@PEG, et les résultats ont été montrés sur la Fig. 5. Nous pouvons voir qu'aucun changement évident dans l'histologie des principaux organes n'a été observé, et le plus important, il n'y a pas de nanoparticules AuNS@PEG résiduelles dans ces organes. Sur la base des résultats ci-dessus, les nanoparticules AuNS@PEG ont présenté une bonne biocompatibilité et aucune toxicité in vivo évidente, ce qui en fait un nouvel agent de contraste d'imagerie CT pour une application en médecine biologique.
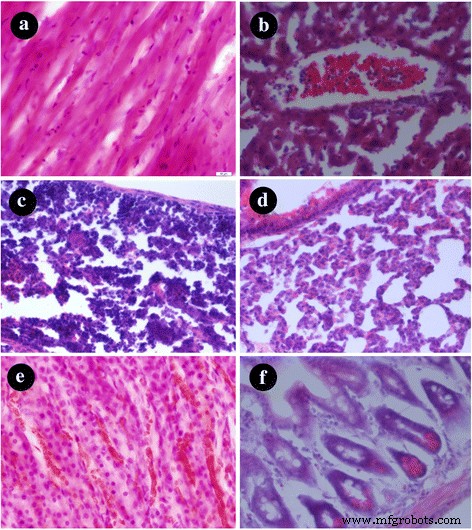
Coupes de tissus colorées avec H&E :a coeur, b foie, c rate, d poumon, e rein, et f intestin. Les barres d'échelle représentent 100 mm
Étude de la fonction rénale des nanoparticules AuNS@PEG
Pour évaluer davantage la toxicité in vivo des nanoparticules AuNS@PEG, les paramètres de BUN, Crea, β2 -MG et CO2 ont été mesurés pour les études de la fonction rénale ; nous avons analysé le sérum. Ces valeurs permettent d'évaluer si la fonction rénale du rat est bonne ou non. Les valeurs de BUN peuvent évaluer la fonction urinaire du rat. La valeur changeante de Crea représente les diverses maladies dans le corps du rat. Le β2 -La concentration de MG est principalement liée à la fonction tubulaire rénale. Et la valeur du CO2 peut évaluer la fonction d'acidification du tubule rénal. Le rat a reçu des nanoparticules AuNS@PEG à une concentration de 200 ppm. Le niveau de ces résultats a été examiné 24 h après l'injection, et il n'y avait pas de différence entre avant et après l'injection de nanoparticules AuNS@PEG chez le rat (Tableau 1).
Conclusions
En résumé, nous avons développé des nanoparticules AuNS@PEG faciles pour des applications en imagerie CT. Les nanoparticules AuNS@PEG formées ont des tailles ultrapetites, une faible toxicité, une bonne dispersibilité dans l'eau, une hémocompatibilité et une cytocompatibilité dans la plage de concentration donnée. Les valeurs CT montrent que les nanoparticules AuNS@PEG ont une bonne imagerie lumineuse. Les résultats d'imagerie in vitro indiquent que les nanoparticules AuNS@PEG possèdent de fortes propriétés d'atténuation des rayons X en tant que nouvel agent de contraste pour les applications d'imagerie CT, qui ont également été démontrées par l'imagerie CT de rein de rat in vivo. De plus, la distribution des études biologiques et l'exploration de la toxicité in vivo montrent que les nanoparticules AuNS@PEG peuvent se métaboliser et avoir une compatibilité biologique élevée. Ainsi, les nanoparticules AuNS@PEG peuvent être des candidats prometteurs pour des applications médicales.
Nanomatériaux
- Nanoparticules semi-conductrices
- Nanoparticules d'or multifonctionnelles pour des applications diagnostiques et thérapeutiques améliorées :une revue
- Nanoparticules pour le traitement du cancer :progrès actuels et défis
- Préparation et propriétés magnétiques des nanoparticules de spinelle FeMn2O4 dopées au cobalt
- Synthèse facile et propriétés optiques de petits nanocristaux et nanotiges de sélénium
- Nanotechnologie :du système d'imagerie in Vivo à l'administration contrôlée de médicaments
- Nouveaux nanoparticules Au Nanostars@PEG biocompatibles pour l'imagerie CT in vivo et les propriétés de clairance rénale
- Synthèse et performances in vitro de nanoparticules de fer-platine revêtues de polypyrrole pour la thérapie photothermique et l'imagerie photoacoustique
- Nouveau double mitochondrial et récepteur CD44 ciblant des nanoparticules pour une libération déclenchée par des stimuli redox



