Nanoparticules de laminarine chargées en protoporphyrine IX pour le traitement anticancéreux, leur comportement cellulaire, la détection des ROS et les études animales
Résumé
Dans cette étude, des particules nanométriques à base de conjugué de laminarine ont été proposées comme système d'administration de la protoporphyrine IX (Pp IX) dans la thérapie photodynamique (PDT) des cellules cancéreuses du sein humaines (MCF-7). L'hématine-laminarine-acide dithiodipropionique-MGK, nommé HLDM, était un matériau support amphiphile à double sensibilité au pH/redox qui pouvait être utilisé pour charger un médicament hydrophobe afin d'améliorer sa solubilité et sa biocompatibilité. Par conséquent, nous avons combiné un photosensibilisateur (Pp IX) avec du HLDM pour fabriquer de nouvelles nano-micelles, appelées ici micelles HLDM chargées de Pp IX. Les micelles HLDM chargées de Pp IX avaient une taille de 149,3 ± 35 nm dans de l'eau neutre. La phototoxicité, l'effet PDT in vitro et la double sensibilité au pH et au microenvironnement redox des micelles HLDM chargées de Pp IX ont été examinés à différentes concentrations en utilisant des cellules de cancer du sein humain MCF-7. Les expériences sur la phototoxicité et la production d'espèces réactives de l'oxygène (ROS) ont prouvé que les micelles pouvaient produire de la PDT pour tuer les cellules cancéreuses avec une certaine longueur d'onde de lumière. L'expérience d'apoptose a indiqué que les micelles pourraient causer des dommages nucléaires. L'effet PDT in vivo des micelles a été étudié en construisant le modèle de souris nude porteuses de tumeurs de cellules MCF-7. Des études in vivo ont montré que les micelles HLDM chargées de Pp IX pouvaient induire un effet anti-tumoral remarquable. Une plate-forme de nanomédecine à base de laminarine prometteuse agit comme un nouveau système d'administration de médicaments pour améliorer l'absorption, l'accumulation et l'efficacité PDT de la Pp IX in vitro et in vivo.
Introduction
La thérapie photodynamique (PDT) [1,2,3] est un type établi de thérapie affectée par la source lumineuse, le photosensibilisateur et l'oxygène moléculaire [4], qui peut produire des espèces réactives de l'oxygène (ROS) médiées [5, 6] mortelles directes effets sur les cellules cancéreuses dans la zone éclairée dans des conditions de nature minimalement invasive [6] et de faible toxicité. Il peut provoquer des dommages à l'ADN [7], activer des voies de signalisation pour faciliter la réaction vasculotoxique qui interdit l'apport sanguin à la zone tumorale [8] et provoquer la reconnaissance et la destruction des cellules tumorales par le système immunitaire [9]. L'effet ultime est de surmonter la résistance aux médicaments [10, 11] et de provoquer un effet antitumoral sélectif, entraînant la mort des cellules cancéreuses.
À l'heure actuelle, les traitements traditionnels des tumeurs [12], tels que la radiothérapie, la chimiothérapie et la chirurgie, sont largement utilisés en clinique, mais ces méthodes ont de grands effets toxiques et secondaires, un grand traumatisme, un grand risque, certaines limitations et une récidive facile. La PDT est utilisée dans le traitement du cancer étendu, y compris le cancer du sein [13,14,15], des hépatocytes [14], du poumon [16], du mélanome [17] et de la peau [18], devenant le centre d'intérêt des chercheurs nationaux et étrangers. . L'expérience a prouvé que la PDT est un meilleur choix pour alterner les méthodes conventionnelles comme la chimiothérapie [19] et la chirurgie dans le traitement de diverses maladies et tumeurs [20], car elle présente des avantages tels que l'inhibition des métastases cancéreuses [21] et est sélective et adaptable. Cependant, les applications de la plupart des photosensibilisateurs ont été limitées dans le traitement du cancer en raison de leur accumulation limitée sur le site tumoral [22].
La protoporphyrine IX (Pp IX) est un photosensibilisateur hydrophobe [23, 24] qui a un grand potentiel pour une utilisation dans le diagnostic et la PDT. La Pp IX est un dérivé de l'hématoporphyrine qui peut également provoquer l'apoptose sans stimulus externe (comme la lumière laser [25]), ce qui montre qu'il est susceptible d'avoir une fonction nouvelle pour remédier au cancer [26].
L'accumulation topique de Pp IX dans les lésions précancéreuses et malignes est donc une stratégie intéressante à fournir [27], car sa fluorescence fournit une méthode pratique pour l'orientation de la tumeur [28].
Cependant, Pp IX présente certains inconvénients qui doivent être résolus [29], tels qu'il a une faible solubilité et est facile à agréger en solution aqueuse, ce qui entraîne une efficacité réduite. Par conséquent, la laminarine [30] est un biomatériau porteur de nanomédecine marine qui est utilisé comme porteur de groupe hydrophile pour améliorer les caractéristiques défavorables des photosensibilisateurs. Il a été prouvé que la laminarine possède des activités biologiques efficaces, notamment antitumorales, antivirales, etc. L'accumulation de preuves suggère [31] qu'il a une bonne efficacité thérapeutique sur différents types de cellules cancéreuses in vitro et in vivo (telles que les cellules cancéreuses du sein et du côlon [32]).
Les nanoparticules polymères sensibles à la stimulation, telles que les liposomes et les micelles, peuvent en outre assurer l'administration de médicaments et réduire les effets secondaires. Les liposomes [33] peuvent être utilisés comme outils diagnostiques et thérapeutiques, et l'amphotéricine B peut être incorporée dans les liposomes pour traiter les infections fongiques [34]. Les nanoparticules micellaires polymériques [35] sont une délivrance intelligente de médicaments [36]. Les micelles d'hématine-laminarine-acide dithiodipropionique-MGK (HLDM) chargées de Pp IX avec double sensibilité au pH/redox et photoréponse contiennent un noyau hydrophobe pour le chargement de Pp IX ainsi qu'une enveloppe hydrophile de laminarine. Ils ont été l'une des méthodes d'administration de médicaments nanoscopiques les plus importantes pour améliorer les caractéristiques défavorables des photosensibilisateurs [37], telles que la biodistribution des médicaments, les effets indésirables et la libération sous charge médicamenteuse [38, 39].
À cet égard, nous avons donc conçu une nanoplateforme multifonctionnelle d'administration de médicaments [40] basée sur la laminarine en réponse au pH [41] et aux propriétés redox [42], qui pourrait maintenir la solubilité dans l'eau et éteindre la Pp IX dans la circulation sanguine d'un corps humain tout en extinction de la Pp IX dans des sites ciblés [43]. Le type d'administration de médicament sensible aux stimuli internes et externes a reçu une attention considérable, tels que la température [44], les ultrasons [45], le pH et l'oxydoréduction. Un système thermoréactif a été étudié pour contrôler l'administration de médicaments, montrant un potentiel pour une meilleure administration de médicaments [46]. Le système d'administration de médicaments répondant aux stimuli a favorisé la libération continue de médicaments à la demande [47] de manière irréversible et distribuée rapidement.
Dans cette étude, des micelles HLDM chargées de Pp IX ont été préparées pour surmonter certains inconvénients de Pp IX [48], tels que l'instabilité et l'agrégation dans la solution aqueuse. Nous avons émis l'hypothèse que les micelles HLDM chargées de Pp IX, auto-assemblées à partir de nanoporteurs HLDM [49], devraient être accumulées et libérées Pp IX dans le microenvironnement tumoral [50]. La Pp IX a été stimulée par pour faciliter la génération de ROS après l'accumulation de Pp IX dans les cellules tumorales, ce qui pourrait provoquer la mort des cellules cancéreuses (comme dans la Fig. 1). La synthèse et la caractérisation des matériaux HLDM ont été prouvées par 1H-RMN comme précédemment rapporté [51]. Ainsi, dans le présent travail, l'absorption cellulaire, la phototoxicité, la génération de ROS, l'observation morphologique nucléaire et l'effet PDT in vivo des micelles HLDM chargées de Pp IX ont été étudiés.
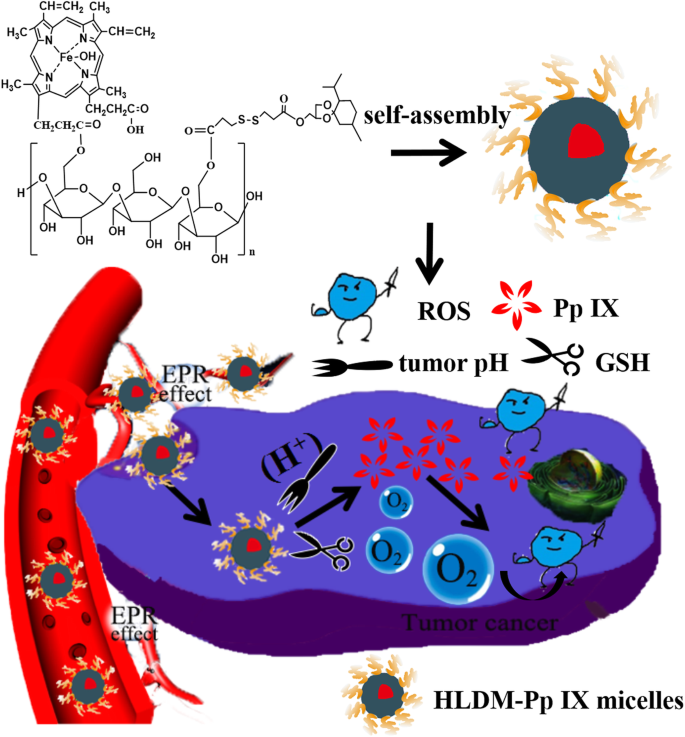
Illustration schématique de la nanomédecine à base de laminarine (HLDM) utilisée pour administrer le photosensibilisateur pour le traitement des tumeurs
Méthodes
Matériaux
La laminarine a été achetée auprès de Sigma-Aldrich (Shanghai, République populaire de Chine). Le diméthylsulfoxyde (DMSO) a été fourni par Tianjin Bodi Co. Ltd. Le l-glutathion (GSH), Hoechst 33342 a été fourni par Sigma-Aldrich (Shanghai, République populaire de Chine). Le milieu Eagle modifié de Dulbecco (DMEM) et le sérum fœtal bovin (FBS) ont été obtenus auprès de Science Biotechnology Co. Ltd. (Shangdong, Yantai, Chine). Le kit d'analyse des espèces réactives de l'oxygène (ROS) a été fourni par Beyotime Biotechnology (Shanghai, Chine). H& E ont été achetés auprès de Bioworld Technology Co. Ltd. (Nanjing, Chine). La Pp IX a été fournie par Aladdin Reagent Net (Shanghai, Chine). Tous les autres réactifs et solvants étaient de qualité chimique.
Les cellules humaines du cancer du sein (MCF-7) ont été fournies par le Laboratoire de pharmacologie moléculaire de l'École de pharmacie de l'Université de Yantai (Shandong, Chine).
Des souris nude femelles pesant 14 à 18 g (3 à 4 semaines) ont été achetées auprès de Beijing Vital River Laboratory Animal Technology Co. Ltd.
Synthèse et caractérisation des matériaux HLDM
Les matériaux HLDM ont été synthétisés et fournis en utilisant les méthodes présentées dans les rapports précédents [51]. Tout d'abord, le chlorure d'oxaloyle a été utilisé pour activer l'acide dithiopropionique en chlorure d'acyle, qui a été acylé avec MGK pour obtenir HOOC-S-S-MGK. Après cela, du chlorhydrate de 1-éthyl-3-(3-diméthylaminopropyl) carbodiimide (EDCI) et de la 4-diméthylaminopyridine (DMAP) ont été utilisés pour activer HOOC-S-S-MGK, puis la réaction d'estérification a été réalisée avec de la laminarine à 40 °C. Enfin, nous avons synthétisé les matériaux HLDM par estérification en utilisant EDC/DMAP comme catalyseur. Le DMSO-D6 et D2 O ont été choisis comme solvant pour analyser la composition des composés. Et 1 Les spectres H-RMN (Advance Bruker 400M ; Switzerland Bruker Company, Madison, WI, États-Unis), les spectres IR et d'absorption UV-visible (200-700 nm) pour les matériaux HLDM ont été testés et déterminés à température ambiante.
Préparation de micelles d'auto-assemblage (micelles HLDM chargées Pp IX)
Les micelles HLDM chargées de Pp IX ont été exploitées par la méthode de dialyse. En un mot, un noyau hydrophobe se compose de MGK, d'acide dithiodipropionique et d'hématine ainsi qu'une enveloppe hydrophile de laminarine pourrait s'auto-assembler dans l'eau pour former des polymicelles. Pp IX a été chargé dans le noyau hydrophobe pendant l'agitation pour obtenir des micelles HLDM chargées de Pp IX. HLDM et Pp IX ont été dialysés dans de l'eau déminéralisée (MWCO 2000 Da) sur un agitateur 90-1 à 600 tr/min après agitation pendant un temps raisonnable dans un réactif organique à dissoudre, suivi d'un traitement ultérieur, pour obtenir des micelles HLDM chargées de Pp IX. Toute la procédure s'est déroulée à température ambiante.
Caractérisation des micelles
La taille des particules et le potentiel zêta pour les micelles HLDM chargées de Pp IX ont été déterminés en utilisant l'analyseur de particules Beckman Coulter (numéro de pièce :A35878) à température ambiante. La morphologie des micelles HLDM chargées de Pp IX a été visualisée par un microscope électronique à transmission H-600 (H-600 TEM; Hitachi, Tokyo, Japon). Pour déterminer la capacité de chargement, des micelles HLDM chargées de Pp IX ont été brisées par un appareil à ultrasons dans un réactif organique. La concentration de Pp IX libre dans les micelles a été mesurée par des spectres d'absorption UV-visible à 630 nm. L'efficacité de piégeage (EE) et le contenu de charge de médicament (DL) ont été calculés selon la formule.
EE (%) =(poids de Pp IX dans les micelles HLDM chargées de Pp IX/poids de l'ensemble de Pp IX) × 100 %
DL (%) =(poids de Pp IX dans les micelles HLDM chargées de Pp IX/poids des micelles) × 100 %
Culture cellulaire
Les lignées cellulaires de cancer du sein humain (MCF-7), les lignées cellulaires de cancer du côlon (CT-26) (Fig. 5) et les lignées cellulaires de cancer du poumon (A549) (Fig. 5) ont été utilisées pour déterminer les micelles HLDM chargées de Pp IX par microscope à fluorescence inversé (AxioVert.A1). Il avait été largement prouvé à titre préliminaire que ces matériaux avaient un effet anti-tumoral. Mais l'expérience a démontré que MCF-7 pourrait avoir une absorption plus importante que les deux autres lignées cellulaires cancéreuses. Ainsi, le MCF-7, cultivé en DMEM (Hyclone) avec 10 % de sérum bovin foetal, a été sélectionné pour surveiller l'effet curatif à 37 °C dans une atmosphère humidifiée contenant 5 % de CO2 .
Captation cellulaire
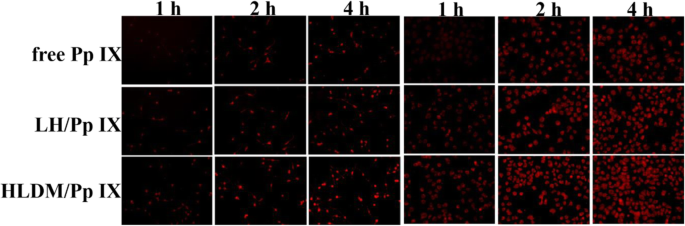
Le milieu frais contenant du Pp IX libre, des micelles de laminarine-hématine (LH) chargées de Pp IX ou des micelles HLDM chargées de Pp IX ont été ajoutés pour remplacer le milieu d'origine après 24 h, respectivement. Les cellules MCF-7 ont ensuite été cultivées pendant 1 h, 2 h et 4 h (concentration Pp IX :20 g/mL) ou pendant 4 h avec les différentes concentrations suivantes de Pp IX :10 g/mL, 20 g/mL, et 50 μg/mL dans l'atmosphère au-dessus. La conséquence de l'absorption cellulaire a été observée au microscope à fluorescence inversé (Eclipse E400; Nikon Corporation, Tokyo, Japon) pour avoir une analyse qualitative [52].
Étude de localisation des cellules
Dans cette étude, Pp IX n'était pas seulement un médicament anticancéreux pour provoquer la mort des cellules cancéreuses, mais aussi une sonde de fluorescence rouge pour localiser l'absorption. Les cellules MCF-7 dans un milieu frais contenant des micelles libres de Pp IX, de LH chargées de Pp IX ou des micelles HLDM chargées de Pp IX ont été cultivées pendant 4 h à une concentration de 20 g/mL au-dessus de l'atmosphère. Après fixation avec du paraformaldéhyde 4%, le fixateur a été remplacé par Hoechst 33342 (10 µg/mL) pour teindre le noyau pendant 15 min. Le résultat de la localisation a été visualisé au microscope à fluorescence inversé.
Mesure de la génération d'espèces réactives à l'oxygène
La capacité de génération d'espèces réactives de l'oxygène (ROS) a été mesurée de manière intracellulaire à l'aide d'un microscope à fluorescence, qui a utilisé la sonde ROS 2′,7′-dichlorofluorescine diacétate (DCFH-DA). Le MCF-7 a été ensemencé dans des plaques à six puits et incubé. Après 24 h, le milieu a été retiré et remplacé par du milieu frais contenant des micelles HLDM libres chargées de Pp IX ou Pp IX (20 µg/mL) pendant 2 h. Les cellules ont été lavées avec du milieu DMEM, suivi d'une irradiation d'une demi-heure (630 nm). Après deux lavages, les cellules MCF-7 ont été incubées avec du DCFH-DA (10 mol/L) à l'atmosphère ci-dessus pendant 30 min, qui ont ensuite été imagées au microscope à fluorescence (longueur d'onde d'excitation :488 nm, longueur d'onde d'émission :525 nm) après un nouveau lavage. avec support DMEM.
Dosages de phototoxicité et de viabilité
Le MCF-7 a été inoculé dans une plante à 96 puits pour détecter la cytotoxicité de différentes formes posologiques pour les tests de viabilité. Ensuite, le DMEM frais comprenant différentes concentrations de Pp IX libre, de micelles de LH chargées de Pp IX ou de micelles HLDM chargées de Pp IX (1, 2, 5 et 10 g/mL) a été ajouté dans chaque puits. Pour le groupe de phototoxicité, les cellules ont été incubées pendant 4 h pour absorber, et elles ont été encore irradiées pendant 30 min, suivies d'une incubation pendant 24 h à l'atmosphère au-dessus. D'autre part, les puits ont été mis en place pour analyser la cytotoxicité et la viabilité à l'obscurité en tant que groupe témoin. Ils ont ensuite été inoculés pendant 24 h au-dessus de l'atmosphère.
Vingt microlitres de solution de bromure de 3-(4,5-diméthylthiazole-2-yl)-2,5-diphényl-tétrazolium (MTT) (5 mg/mL) et 180 L de PBS (pH 7,4) ont ensuite été ajoutés dans 96 puits. plaque et encore incubé pendant 3 h supplémentaires. Par la suite, 150 pi de DMSO ont été utilisés pour solubiliser le produit formazan et l'absorbance (DO) a été mesurée à l'aide d'un instrument à marquage enzymatique (SpectraMax M 5) à 490 nm. La viabilité du MCF-7 a été exprimée en utilisant la formule suivante :
Viabilité = ((OD échantillon-OD noir)/(OD contrôle-OD noir)) × 100 %.
Les valeurs de l'échantillon de DO ont été fournies par les cellules traitées avec le médicament, tandis que les valeurs de contrôle de la DO ont été fournies par les cellules sans médicament, et les valeurs de la DO noire ont été obtenues à partir des puits sans médicament ni cellules.
Observation morphologique nucléaire
La lignée cellulaire MCF-7 a été incubée pendant 24 h, puis stimulée avec des micelles HLDM chargées de Pp IX pendant 4 h. Après rinçage et fixation, les cellules ont été colorées avec une sonde de fluorescence nucléaire pendant 20 min à 37 °C, suivies de l'élimination du colorant de l'environnement à l'aide de PBS. Les images de fluorescence correspondantes ont été visualisées à l'aide d'une microscopie à fluorescence.
Évaluation de l'efficacité et de la sécurité in vivo
Des souris nude femelles ont ensuite été utilisées pour étudier la faisabilité anticancéreuse de micelles HLDM chargées de Pp IX in vivo. Cellules MCF-7 (1,5 × 10 6 cellules/0,1 ml) ont été injectés dans des oxters de souris nude femelles comme modèles animaux, puis des œstrogènes ont été administrés par gavage intragastrique pour favoriser la croissance tumorale. Les souris ont été réparties au hasard en cinq groupes une fois que le volume des tumeurs a atteint environ 70 à 100 mm 3 , qui ont été désignés comme solution saline normale, Pp IX libre (5 mg/kg), micelles HLDM chargées de Pp IX (5 mg/kg d'équivalents Pp IX libres), Pp IX libre (5 mg/kg) plus irradiation lumineuse, et Micelles HLDM chargées de Pp IX (5 mg/kg d'équivalents Pp IX libres) plus irradiation lumineuse. Les groupes traités à la lumière ont été exposés au laser 630 nm avec 30 min à 24 h après l'injection. L'efficacité thérapeutique a été évaluée en surveillant les volumes tumoraux dans cinq groupes traités tous les deux jours et en analysant la lame histopathologique après 20 jours. Et les poids corporels ont été mesurés pour évaluer l'innocuité du médicament dans cinq groupes traités tous les 2 jours [53].
Analyse statistique
Toutes les données de cette étude ont été enregistrées en tant que moyennes ± écart-type (n =3). De plus, des différences significatives entre les différents groupes ont été analysées à l'aide d'une analyse de variation unidirectionnelle (ANOVA). Les différences ont été jugées statistiquement significatives à des niveaux de probabilité de *P < 0,05 (significatif), ***i>P < 0,01 (très significatif).
Résultats et discussion
Caractérisation des matériaux HLDM
1 Les spectres H-RMN pour les matériaux HLDM ont été montrés dans des rapports précédents [51]. Le pic de méthyle pour la MGK a été observé à environ :0,8 (figure 2h). 1 Les spectres H-RMN ont révélé un pic d'absorption à environ :2,8 (Fig. 2g), qui était CH2 dans l'acide 3,3-dithiodipropionique. L'apparition du pic de signal à :6,5 (Fig. 2j) a vérifié la présence d'hématine. Le pic caractéristique de la laminarine dans les matériaux polymères amphiphiles a été trouvé dans la région entre 3 et 4 ppm, indiquant que le nouveau produit de HLDM avait été synthétisé avec succès.
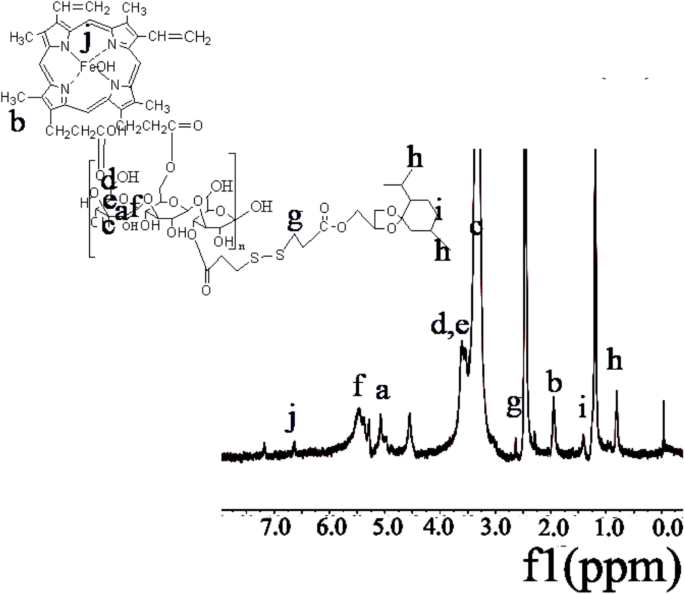
Le 1 Spectres H-RMN de HLDM
Spectres IR pour HLDM
Les spectres IR des matériaux HLDM ont été montrés dans des rapports précédents [51]. Le double pic sur l'image témoignait de la connexion du MCK. De plus, le pic caractérisé du groupe ester carbonyle a été observé dans les spectres IR.
Spectres d'absorption UV-Visible de HLDM
Sur la figure 3a, l'hématine avait une longueur d'onde d'absorption ultraviolette (environ 580 nm) et sur la figure 3b, la laminarine-acide dithiodipropionique-MGK n'avait pas d'absorption dans la même position. Les spectres d'absorption UV-visible ont été réalisés pour vérifier le lien de l'hématine sur cette base. Le résultat a indiqué que la longueur d'onde d'absorption caractérisée à 580 nm a été observée dans les matériaux HLDM (Fig. 3c). L'hématine a été connectée avec succès aux matériaux HLDM.
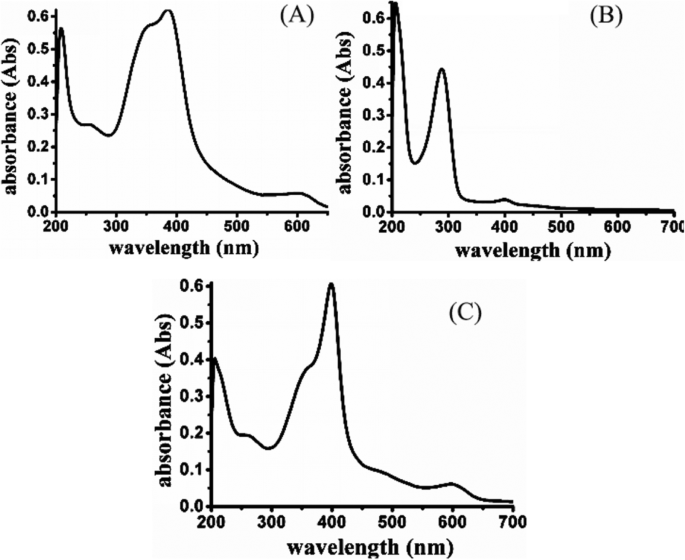
Spectres d'absorption UV-visible de l'hématine (a ), Laminarine-S-S-MGK (b ), et HLDM (c )
Caractérisation des micelles chargées de Pp IX
La taille et le potentiel zêta des micelles HLDM chargées de Pp IX sont illustrés sur les figures 4a, b. Il a été montré que les micelles avaient été mieux absorbées par les cellules cancéreuses, pour améliorer l'efficacité et réduire les effets secondaires (effet de perméabilité et de rétention amélioré, EPR). Les micelles ont été vues à l'œil nu après un filtre à membrane Millipore sur la figure 4c. Sur cette base, l'image des micelles HLDM chargées de Pp IX a été balayée au microscope électronique à transmission (MET) comme le montre la figure 4d. La morphologie était des particules non uniformes, ce qui était dû au manque de temps pour l'échographie. Par contre, l'agglomération des particules a été observée sur la photo, probablement à cause de la concentration plus élevée (Fig. 5).
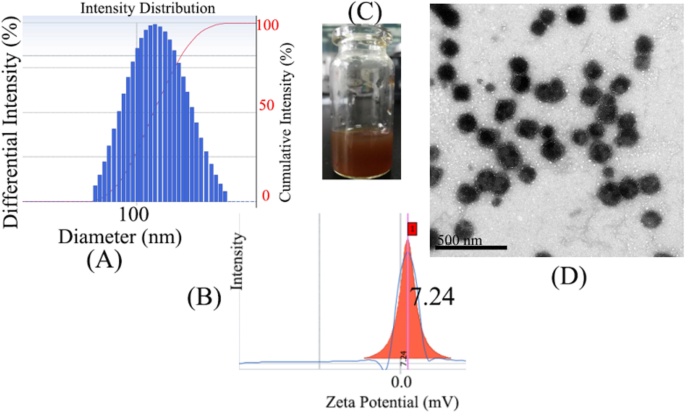
un , b La taille et le potentiel zêta des micelles HLDM chargées de Pp IX. c Les micelles HLDM chargées de Pp IX dans l'eau. d L'image MET de micelles HLDM chargées de Pp IX
Absorption de micelles libres de Pp IX, de LH chargées de Pp IX et de HLDM chargées de Pp IX dans CT-26 (gauche) et A549 (droite)
L'efficacité de piégeage (EE) et le contenu de charge de médicament (DL) ont été calculés par la formule (tableau 1). Il a été découvert après de nombreuses expériences que la fluctuation de l'EE et de la DL était instable, car nous avions supposé que les micelles HLDM chargées de Pp IX pourraient s'agréger en solution aqueuse.
Captation cellulaire
Dans cette étude, la fluorescence de Pp IX a été détectée pour étudier la dépendance en temps et en concentration. Comme le montre le diagramme, les micelles HLDM chargées de Pp IX ont été absorbées dans les cellules MCF-7 et leur intensité de fluorescence a augmenté avec le temps et la concentration. En comparant les trois micelles de la figure 6a, les cellules cancéreuses qui ont reçu des micelles HLDM chargées de Pp IX présentaient plus de fluorescence. Cela était dû au fait que les fractions pH/redox avaient été liées aux matériaux pour répondre au microenvironnement tumoral. Les cellules cancéreuses qui ont reçu de la Pp IX libre avaient une fluorescence plus faible en raison de l'agrégation dans le DMEM.
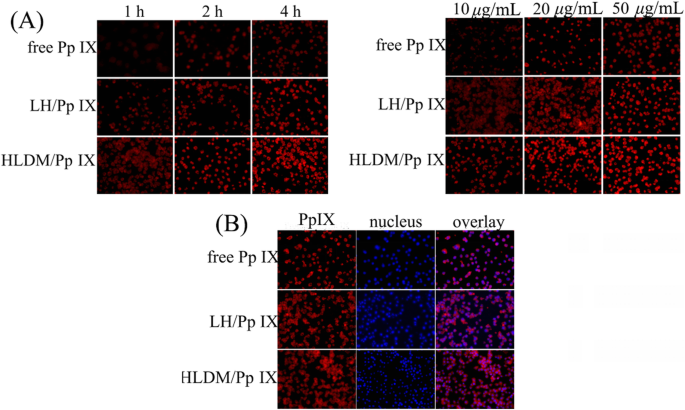
un Absorption de micelles libres de Pp IX, de LH chargées de Pp IX et de HLDM chargées de Pp IX. b Emplacement des cellules des micelles HLDM chargées de Pp IX
De ce qui a été discuté ci-dessus, nous pouvons sans risque tirer la conclusion que les matériaux HLDM, y compris les fractions de sensibilité au pH et à la réduction, peuvent améliorer l'agglomération de Pp IX et améliorer leur absorption et leur libération dans les cellules tumorales.
Étude de localisation des cellules
Comme le montre la figure 6b, le noyau a été coloré par un colorant fluorescent, puis nous avons pu voir le phénomène de fluorescence rouge présenté en dehors de la fluorescence bleue. Nous avions supposé que l'absorption cellulaire pourrait être liée au cytoplasme, cette hypothèse a donc été vérifiée par l'étude précédente selon laquelle la Pp IX avait été accumulée et localisée dans les mitochondries et le cytoplasme des cellules tumorales [54].
Mesure de la génération d'espèces réactives à l'oxygène
Comme le montre la figure 7, les espèces réactives de l'oxygène (ROS) dans les cellules MCF-7 ont été surveillées en utilisant le DCFH-DA comme indicateur, qui avait une fluorescence verte en microscopie à fluorescence. Les micelles HLDM chargées de Pp IX avaient une intensité de fluorescence verte plus forte sous la lumière tandis que la Pp IX libre avait à peine une fluorescence. Nous avions supposé que la Pp IX libre pourrait s'agglomérer pour provoquer un effet d'auto-extinction dans le DMEM. La fluorescence verte de trois groupes était négligeable sans lumière (comme le groupe témoin). Ces résultats ont confirmé que Pp IX pouvait stimuler l'oxygène pour générer des ROS en tant que photosensibilisateur dans des conditions de lumière.
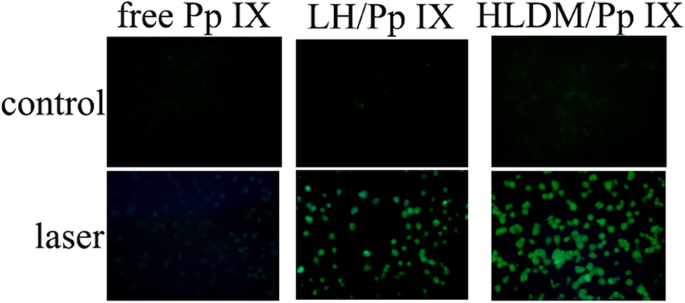
Génération d'espèces réactives de l'oxygène (ROS) dans des conditions de luminosité
Test de phototoxicité et de viabilité
Le test de cytotoxicité et de viabilité cellulaire a été réalisé avec les cellules cancéreuses du sein humain MCF-7 dans deux environnements externes différents, en utilisant le test MTT. Comme le montre la figure 8a, la différence significative de dommages cellulaires était négligeable dans tous les échantillons dans l'obscurité. Lorsque la concentration de Pp IX a été augmentée à 50 g/mL, la viabilité des cellules MCF-7 que nous avons détectées est restée à un niveau élevé. Le phénomène a montré que la cytotoxicité pour les cellules ou les organes n'était pas augmentée de manière significative avec une concentration accrue de Pp IX.
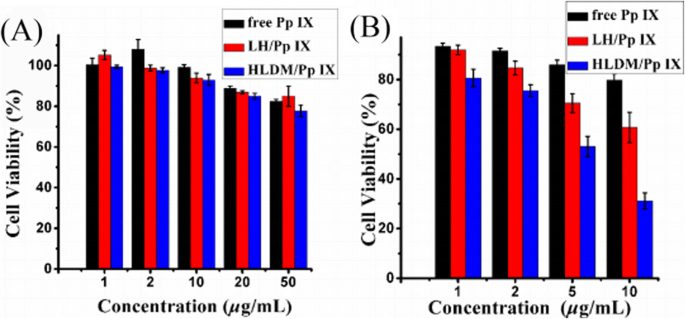
un Viabilité des cellules MCF-7 des micelles libres de Pp IX, de LH chargées de Pp IX ou de micelles HLDM chargées de Pp IX dans des conditions d'éclairage. b Toxicité relative à la lumière des micelles libres de Pp IX, de LH chargées de Pp IX ou de micelles HLDM chargées de Pp IX lors de l'irradiation. n =3 ; * indique P < 0,05
Comme le montre la figure 8b, 5 Les g/mL de Pp IX présentaient une différence significative dans les groupes de médicaments libres et de micelles. La cytotoxicité pour les cellules ou les organes a augmenté de manière significative dans le groupe des micelles, car la concentration de Pp IX a augmenté sous la lumière, tandis que les groupes de Pp IX libres ont montré peu de changement jusqu'à une concentration de 10 g/mL. Ces données ont montré que l'efficacité phototoxique des micelles chargées de Pp IX était nettement supérieure à celle de Pp IX libre. Une fois de plus, l'expérience a démontré que le photosensibilisateur libre pouvait s'accumuler pour provoquer un effet d'auto-extinction. Par conséquent, nous pouvons conclure que les micelles HLDM chargées de Pp IX ont un énorme potentiel pour tuer les cellules cancéreuses avec une irradiation lumineuse.
Observation morphologique nucléaire
Dans l'étude de localisation des cellules, nous avons découvert involontairement que le noyau coloré présentait des taches blanches et que la concentration plus élevée de Pp IX était plus évidente avec ce phénomène. Peut-être que c'était à cause des dommages à l'ADN dans le noyau. Comme le montre la figure 8, 20 g/mL de micelles HLDM chargées de Pp IX pourraient endommager l'ADN par rapport au contrôle correspondant dans MCF-7. Lorsque la concentration atteignait 50 μg/mL, les dommages seraient graves dans les cellules cancéreuses. L'étude d'observation morphologique nucléaire a suggéré que les dommages à l'ADN étaient un marqueur précoce de la mort des cellules MCF-7 induite par Pp IX [26] (Fig. 9).
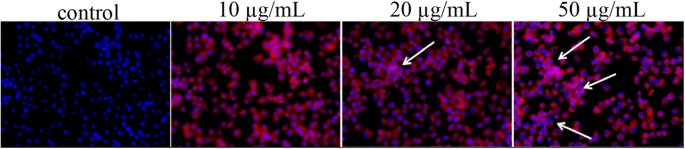
Dommages à l'ADN des cellules MCF-7 après traitement Pp IX
Évaluation de l'efficacité et de la sécurité in vivo
Comme le montrent les figures 10a, b, la croissance tumorale de cinq groupes a été mesurée pour évaluer l'efficacité in vivo. Le groupe traité avec une solution saline a présenté une croissance continue à un taux relativement élevé. Il n'y avait pas de différence significative entre les groupes traités avec des micelles HLDM libres de Pp IX et chargées de Pp IX et le groupe salin. Ces données ont indiqué que le volume tumoral était moins affecté par la Pp IX sans irradiation. Pendant ce temps, le groupe traité avec de la Pp IX libre plus de la lumière a produit un léger changement dans le volume de la tumeur. Ce qui a causé ce phénomène était que le médicament libre était instable in vivo et était donc facile à collecter dans le sang. Par conséquent, il pourrait avoir été éliminé avant d'atteindre le tissu tumoral. En revanche, la croissance tumorale traitée avec des micelles HLDM chargées de Pp IX était significativement inhibée sur la figure 10a. Ce phénomène a prouvé que les micelles présentaient un effet antitumoral significatif après avoir donné une certaine longueur d'onde de lumière à stimuler. Pour résumer, cette expérience a démontré que les effets antitumoraux des micelles HLDM chargées de Pp IX s'étaient manifestement améliorés dans des conditions de lumière.
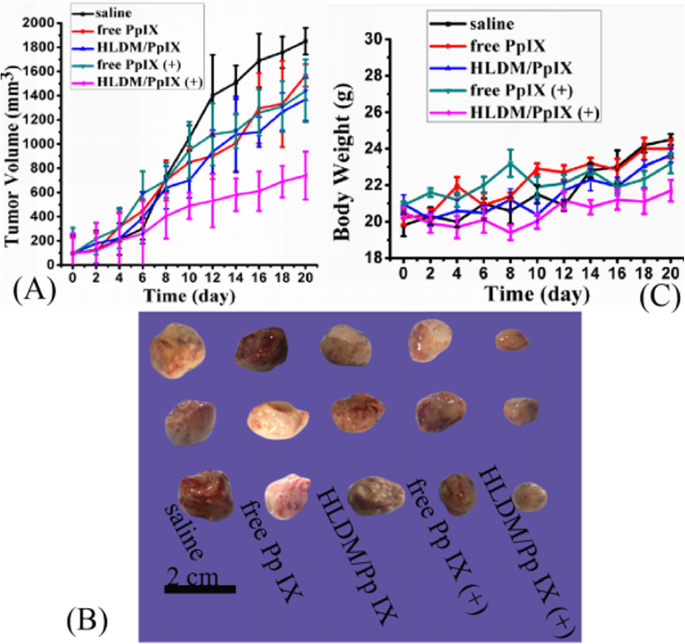
Activité antitumorale in vivo et évaluation de l'innocuité. un Le volume de la tumeur change au cours des temps de traitement. b Volume tumoral de cinq groupes :(a ) solution saline normale, (b ) Pp IX libre (5 mg/kg), (c ) Micelles HLDM chargées en Pp IX (5 mg/kg d'équivalents Pp IX libres), (d ) Pp IX libre (5 mg/kg) plus irradiation lumineuse, et (e ) Micelles HLDM chargées de Pp IX (5 mg/kg d'équivalents Pp IX libres) plus irradiation lumineuse. c Le changement corporel des souris nudes porteuses de tumeurs
D'autre part, le poids corporel relatif a été mesuré pour évaluer la sécurité des micelles HLDM chargées de Pp IX (Fig. 10c). Il n'y a eu aucune perte de poids corporel évidente et des changements négligeables dans tous les groupes, suggérant la bonne biosécurité de ces traitements pour les souris.
De plus, la lame histopathologique a montré un polymorphisme nucléaire clair dans le groupe salin de la figure 11. Les changements pathologiques dans le tissu tumoral coloré à l'hématoxyline et à l'éosine (H&E) présentaient une différence significative dans cinq groupes. Les résultats ont montré une légère condensation nucléaire dans les micelles HLDM chargées de Pp IX et les groupes Pp IX libres. Les tissus tumoraux du groupe de micelles HLDM chargées de Pp IX (plus de lumière) présentaient des dommages nucléaires évidents. Par conséquent, nous avons conclu que ces résultats étaient cohérents avec les résultats ci-dessus pour l'évaluation de l'efficacité et de l'innocuité in vivo.
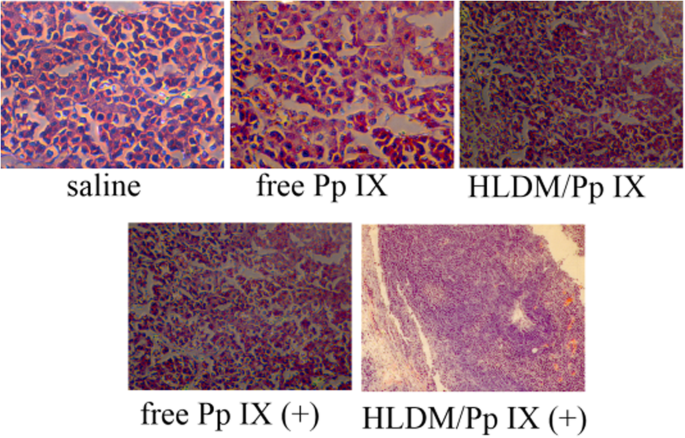
Coloration des tumeurs H&E avec différentes formulations. Toutes les données sont rapportées en moyenne ± SD. n =3 ; * indique P < 0,05
À ce jour, divers matériaux ont été étudiés pour l'administration de médicaments [55]. Dans l'étude précédente, nous avons synthétisé avec succès des conjugués de laminarine de polysaccharide marin sensibles au pH/redox [56], et dans cette recherche, les conjugués ont été utilisés comme système d'administration de la Pp IX, pour obtenir des effets anti-tumoraux. Des expériences in vivo ont montré que les micelles HLDM chargées de Pp IX pouvaient effectivement délivrer Pp IX dans les cellules cancéreuses et générer des effets létaux directs induits par les ROS sur les cellules cancéreuses. Les expériences de cytotoxicité ont montré que les micelles présentaient une légère cytotoxicité sans irradiation lumineuse, tandis que les solutions à faible concentration de micelles avaient un impact notable sur la viabilité cellulaire dans un certain éclairage. Au niveau animal, les micelles HLDM chargées de Pp IX ont exercé un effet phototoxique pour produire un effet anti-tumoral pertinent. Par conséquent, les activités des micelles HLDM chargées de Pp IX ont été certifiées de manière convaincante in vitro et in vivo.
Conclusions
A novel laminarin-based nanomedicine platform to address undesirable characteristics of Pp IX such as instability and astatic distribution was successfully studied in this research. The photosensitivity and phototoxicity of Pp IX-loaded HLDM micelles were detected and evaluated in vitro and in vivo. Nuclear morphological observation of Pp IX showed that the Pp IX-loaded HLDM micelles could effectively deliver and accumulate Pp IX to cancer cells and cause nuclear damage. The research on phototoxicity and ROS production manifested that Pp IX-loaded HLDM micelles exhibited a relevant PDT effect, exerting anti-tumor activity with a certain wavelength light. Likewise, the in vivo research testified that the Pp IX-loaded HLDM micelles could induce PDT effect under the light condition, which could remarkably enhance the anti-tumor effect of Pp IX. To sum up, the results for in vitro and in vivo studies indicated that Pp IX-loaded HLDM micelles could effectively produce PDT effect and can be applied in the future in tumor treatment in the next research. This promising laminarin-based nanomedicine platform will have great potential for becoming new drug delivery system [57] to deliver hydrophobic photosensitizer for cancer photodynamic therapy (PDT).
Disponibilité des données et des matériaux
Les ensembles de données soutenant les conclusions de cet article sont inclus dans l'article.
Abréviations
- HLDM:
-
Hematin-Laminarin-Dithiodipropionic acid-MGK
- LH:
-
Laminarin-Hematin
- Pp IX:
-
Protoporphyrin IX
- PDT :
-
Thérapie photodynamique
- ROS :
-
Espèces réactives de l'oxygène
Nanomatériaux
- Démonstration d'un biocapteur flexible à base de graphène pour la détection sensible et rapide des cellules cancéreuses de l'ovaire
- Nanoparticules d'or multifonctionnelles pour des applications diagnostiques et thérapeutiques améliorées :une revue
- Nanoparticules pour le traitement du cancer :progrès actuels et défis
- Préparation de nanoparticules mPEG-ICA chargées en ICA et leur application dans le traitement des dommages cellulaires H9c2 induits par le LPS
- Nanoparticules de chitosane chargées de génistéine et de bioflavonoïdes ciblés sur les récepteurs folates pour un effet anticancéreux amélioré dans les cancers du col de l'utérus
- Nouveaux nanoparticules Au Nanostars@PEG biocompatibles pour l'imagerie CT in vivo et les propriétés de clairance rénale
- La préparation de la nanostructure jaune-enveloppe Au@TiO2 et ses applications pour la dégradation et la détection du bleu de méthylène
- Propriétés des nanoparticules d'oxyde de zinc et leur activité contre les microbes
- Synthèse facile de nanoparticules d'iridium sans ligand et leur biocompatibilité in vitro



