L'oxyde de graphène dans un composite avec des nanoparticules d'argent réduit la cytotoxicité des fibroblastes et des cellules endothéliales d'une nanoplateforme antibactérienne
Résumé
Les surfaces antibactériennes recouvertes de nanomatériaux, y compris les nanoparticules d'argent, sont considérées comme des agents antimicrobiens alternatifs efficaces qui peuvent être utilisés à la place des antibiotiques et des agents chimiques. Cependant, les rapports sur la toxicité potentielle de ces matériaux soulèvent des questions sur la sécurité de leur utilisation dans des applications biomédicales. L'objectif de cette recherche était de réduire la cytotoxicité des cellules humaines de feuilles de polyuréthane recouvertes de nanoparticules d'argent en complexant les nanoparticules d'argent avec de l'oxyde de graphène. L'activité antimicrobienne des nanoplates-formes recouvertes de nanoparticules d'argent, d'oxyde de graphène et du composite de nanoparticules d'argent et d'oxyde de graphène a été évaluée avec Salmonella enteritidis . La cytotoxicité a été analysée par une analyse de la viabilité et de la morphologie des fibroblastes humains, des cellules endothéliales de la veine ombilicale humaine (HUVEC) et de la membrane chorioallantoïque d'embryon de poulet. De plus, le niveau de synthèse des protéines inflammatoires a été examiné pour les fibroblastes cultivés sur différentes nanoplateformes. La nanoplate-forme recouverte de nanoparticules d'argent et d'oxyde de graphène a montré les propriétés antibactériennes les plus fortes, bien que les nanoplateformes recouvertes uniquement de nanoparticules d'argent ou d'oxyde de graphène aient également entraîné une diminution de S. enteritidis croissance. De plus, une nanoplateforme recouverte de nanoparticules d'argent et d'un composite d'oxyde de graphène a montré une stimulation immunologique limitée et une cytotoxicité significativement réduite envers les fibroblastes, les HUVEC et la membrane chorioallantoïque d'embryon de poulet par rapport à la nanoplateforme recouverte uniquement de nanoparticules d'argent, en raison de la plus grande stabilité des nanomatériaux dans le nanocomposite.
Introduction
Les matériaux avec des surfaces antibactériennes ont été largement explorés pour une utilisation en médecine et dans l'industrie biomédicale [1]. Les nanomatériaux sont considérés comme des agents antimicrobiens alternatifs efficaces qui peuvent être utilisés à la place des antibiotiques et des agents chimiques [2]. Les nanoparticules d'argent (AgNPs) sont le plus souvent utilisées pour leurs propriétés antibactériennes [3]. Cependant, les nanoparticules qui présentent une activité antimicrobienne, y compris les AgNP, en particulier à des concentrations plus élevées, peuvent être toxiques pour les cellules humaines et potentiellement affecter la santé humaine [4, 5]. Par conséquent, dans l'industrie biomédicale, l'application de matériaux avec des surfaces recouvertes de nanomatériaux soulève des questions sur leur sécurité et leur toxicité.
L'une des voies possibles pour minimiser la toxicité potentielle des nanomatériaux est de limiter leur mobilité sans modifier leurs propriétés antimicrobiennes. Les nanomatériaux fermement attachés utilisés dans les surfaces antibactériennes qui ne se détachent pas du matériau réduisent leur toxicité pour les cellules humaines [6]. L'une des méthodes efficaces de revêtement de surfaces avec des nanoparticules est la technologie à ultrasons [7]. Les ondes ultrasonores entraînent des modifications structurelles des nanomatériaux, entraînant une désagglomération ou une agglomération, selon le nanomatériau [8]. La technologie des ultrasons peut également être utilisée pour la synthèse de nanocomposites à partir de différents matériaux, notamment des ions métalliques et des nanoparticules [9,10,11]. La sonication a été utilisée pour l'assemblage de différents nanomatériaux, y compris la décoration de paillettes d'oxyde de graphène (GO) avec des AgNPs et d'autres nanoparticules [12].
Le mécanisme de l'activité antibactérienne des nanoparticules varie entre les différents types de nanoparticules; cependant, les principaux processus responsables des propriétés antimicrobiennes des nanoparticules sont les suivants :interactions directes avec les composants cellulaires et processus indirects comprenant l'oxydation des composants cellulaires et la perturbation des processus oxydoréducteurs [3]. L'activité antibactérienne AgNP résulte de la perturbation directe de la membrane cellulaire bactérienne par les AgNPs et les ions Ag+ libérés, induisant la synthèse d'espèces réactives de l'oxygène (ROS), et l'effondrement du potentiel de la membrane plasmique, ce qui conduit à l'épuisement de l'ATP intracellulaire [13 ,14,15]. GO peut être cytotoxique pour les cellules bactériennes en raison de la synthèse des ROS et de l'immobilisation directe des cellules sur la surface GO [16, 17], causée par les capacités d'adsorption élevées des nanocomposites GO et GO [18, 19].
Cependant, la toxicité des nanoparticules n'a pas seulement été observée dans les cellules bactériennes. Généralement, les cellules humaines sont moins vulnérables aux nanoparticules que les bactéries en raison de leur plus grande échelle et de leurs mécanismes de réparation et de défense efficaces, mais une cytotoxicité a été observée, en particulier à des concentrations élevées. La toxicité de l'AgNP dans les études in vitro se produit à des concentrations d'un ordre de grandeur similaire, bien qu'elles puissent varier considérablement pour des systèmes biologiques ou des organismes différents plus complexes [20]. La toxicité des AgNPs pour les organismes multicellulaires est souvent plus faible en raison de leurs différences structurelles et physiologiques, telles que les tissus cellulaires spécialisés, y compris les cellules épithéliales [21]. La biocompatibilité de GO pour les cellules humaines dépend de la concentration et de la morphologie de la feuille. À des concentrations plus élevées, GO peut entraîner une pénétration de la membrane plasmique et une synthèse accrue de ROS [22,23,24].
Dans nos études précédentes, nous avons montré que les nanoplateformes composées de nanocomposite AgNP et GO (Ag-GO) ont une efficacité antimicrobienne élevée vis-à-vis des bactéries (Escherichia coli , Staphylococcus aureus et Staphylococcus epidermidis ) et levures pathogènes (Candida albicans ), qui était liée à l'augmentation de la synthèse des ROS et à la perforation de la membrane plasmique [25]. Ag-GO a montré une activité antibactérienne plus élevée que les nanoplateformes AgNP ou GO, en raison de l'activité combinée des deux nanomatériaux. Ici, nous avons émis l'hypothèse que les feuilles de polyuréthane recouvertes de nanocomposite Ag-GO auraient une toxicité plus faible envers les fibroblastes, les cellules endothéliales de la veine ombilicale humaine (HUVEC) et un modèle in vivo alternatif—membrane chorioallantoïque d'embryon de poulet—que les feuilles recouvertes uniquement d'AgNPs.
Résultats
AgNPs et GO ont formé un nanocomposite dans un hydrocolloïde
L'analyse au microscope électronique à transmission (MET) a été utilisée pour évaluer la morphologie des nanomatériaux et leurs interactions au sein du composite Ag-GO (Fig. 1). Les AgNPs étaient des nanoparticules sphériques qui avaient une taille moyenne d'environ 55 nm. De plus, les images MET ont montré l'adhésion des nanoparticules d'argent à GO (Fig. 1e). Ces observations ont été confirmées davantage dans l'analyse du potentiel zêta. Le potentiel zêta de Ag-GO a indiqué que l'hydrocolloïde était instable immédiatement après la sonication, mais s'est stabilisé après 24 h (potentiel zêta :- 15,68 et - 27,7 mV, respectivement ; Tableau 1). En revanche, l'hydrocolloïde AgNP était instable à la fois immédiatement après la sonication et après 24 h, tandis que l'hydrocolloïde GO était assez stable et n'a pas changé de manière significative après 24 h (potentiel zêta :- 31,11 mV et - 28,42 mV, respectivement). De plus, l'analyse de diffusion dynamique de la lumière (DLS) a montré que le Z -la taille moyenne des AgNPs était de 93,1 nm, GO était de 1485,0 nm et Ag-GO était de 1157,0 nm. La distribution granulométrique AgNP indiquait trois pics associés à la formation d'agglomérats, tandis que la distribution granulométrique GO et Ag-GO indiquait un pic (Fig. 1b, d, f).
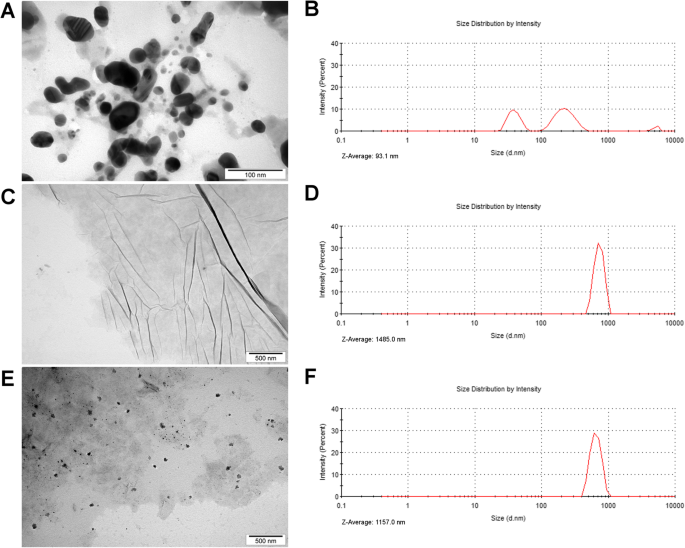
Morphologie et distribution de taille des nanoparticules. Images de microscopie électronique à transmission de a nanoparticules d'argent, c oxyde de graphène et e nanoparticules d'argent et composite d'oxyde de graphène. Distribution de taille de b nanoparticules d'argent, d oxyde de graphène et f nanoparticules d'argent et composite d'oxyde de graphène
Les spectres Raman et la spectroscopie infrarouge à transformée de Fourier (FT-IR) ont été utilisés pour caractériser les caractéristiques structurelles de GO (Fig. 2). La figure 2a montre la déconvolution des D, G et D’ de GO. La position de la bande D est de 1347 cm − 1 et la bande G 1578 cm − 1 ; le rapport DI/IG est de 1,34. L'analyse FT-IR a révélé un large pic observé à ~ 3500 cm − 1 , qui est attribué principalement à l'eau et aux groupes hydroxyle. Le pic autour de 1600 cm − 1 est attribué aux liaisons C=C présentes dans le carbone graphitique. D'autres pics observés sur le spectre FT-IR montrent que GO est riche en groupes contenant des liaisons C=O (principalement des groupes carboxyles), des pics autour de 1720 cm − 1 et 915 cm − 1 , époxy (C–O–C) avec le pic visible autour de 1200 cm − 1 , et les liaisons C–H (pic autour de 2800 cm − 1 ).
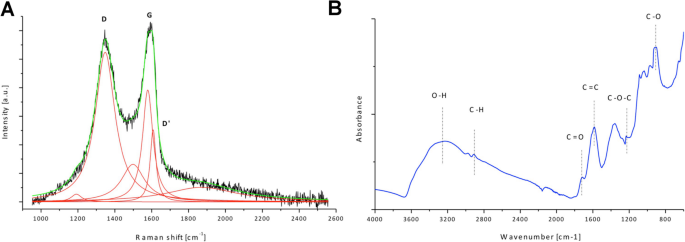
Analyse des caractéristiques structurelles de l'oxyde de graphène. un Spectre Raman de l'oxyde de graphène avec déconvolution proposée des D, G et D'. b Spectroscopie infrarouge à transformée de Fourier (ATR, réflectance totale atténuée) de l'oxyde de graphène avec attribution de groupes fonctionnels
Feuilles revêtues AgNP, GO et Ag-GO Réduction Salmonella enteritidis Croissance
L'activité antibactérienne des nanoplateformes GO, AgNP et Ag-GO a été testée avec S. enteritidis . L'incubation de bactéries sur des feuilles recouvertes de nanomatériaux à 37 °C pendant 24 h a entraîné une diminution de la croissance (Fig. 3). Le plus fort S. enteritidis une inhibition de la croissance a été observée sur la nanoplateforme Ag-GO. Cependant, les nanoplateformes AgNP et GO ont également entraîné une diminution du S. enteritidis croissance. Une comparaison des images au microscope électronique à balayage (MEB) de bactéries incubées sur la nanoplate-forme Ag-GO avec le groupe témoin a montré un nombre réduit de S. enteritidis cellules. De plus, les bactéries ont adhéré aux nanoplates-formes et ont montré des changements morphologiques, indiquant la rupture de leur membrane cellulaire.
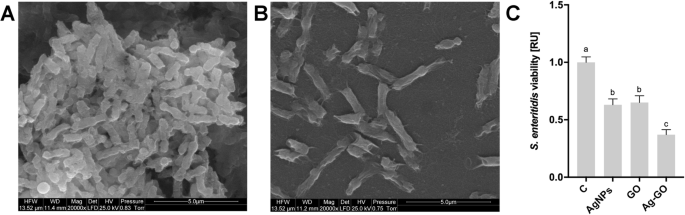
Les nanoplateformes recouvertes de nanoparticules d'argent et d'oxyde de graphène ont diminué la viabilité de S. enteritidis. Images au microscope électronique à balayage de a contrôler S. enteritidis bactéries et b S. enteritidis incubé sur une nanoplateforme recouverte de nanoparticules d'argent et d'oxyde de graphène, après incubation à 37 °C pendant 24 h. c Viabilité de S. enteritidis après incubation sur la nanoplateforme pendant 24 h a été évaluée avec un test PrestoBlue. Les valeurs sont exprimées en moyenne ± écart type (n = 3, chaque expérience en triple). La signification statistique est indiquée par différents exposants (ANOVA à un facteur ; P < 0,05). Abréviations :C, groupe témoin (feuille sans nanoparticules); AgNPs, nanoplateforme recouverte de nanoparticules d'argent ; GO, nanoplateforme recouverte d'oxyde de graphène ; Ag-GO, nanoplateforme recouverte d'un composite d'oxyde de graphène et de nanoparticules d'argent ; RU, unités relatives
La toxicité AgNP est inhibée par GO dans une nanoplateforme à revêtement composite Ag-GO
La toxicité des nanoplates-formes a été étudiée par l'incubation directe de fibroblastes et de HUVEC pendant 24 h sur des nanoplates-formes et des feuilles non revêtues (Fig. 4). Il y avait des différences significatives entre la viabilité des fibroblastes et des HUVEC sur les différentes nanoplateformes (P = 0,0003 et P =0,0156, en conséquence). Les nanoplateformes GO n'ont pas modifié la viabilité des fibroblastes, par rapport à la viabilité des cellules incubées sur des feuilles non revêtues. De même, il n'y a pas eu d'impact significatif du GO sur la viabilité des HUVEC. Cependant, le revêtement avec des AgNPs a entraîné une diminution de 40 à 50 % de la viabilité des fibroblastes et des HUVEC. La viabilité cellulaire des fibroblastes et des HUVEC n'a pas été modifiée lorsqu'ils ont été incubés sur des nanoplateformes recouvertes de nanocomposite Ag-GO, montrant l'inhibition de la toxicité de l'AgNP. La morphologie cellulaire sur des feuilles non revêtues a montré la morphologie typique des fibroblastes cultivés dans des conditions de culture 2D (Fig. 4a). Les cellules incubées sur une feuille revêtue d'AgNP ont montré une agrégation intensive de cellules. La morphologie cellulaire sur les nanoplates-formes recouvertes de GO et d'Ag-GO a montré une réduction des tendances à l'agglomération et à la propagation des cellules.
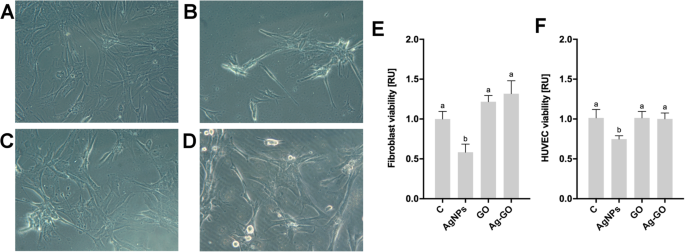
Les nanoplateformes recouvertes d'oxyde de graphène ont diminué la cytotoxicité des nanoparticules d'argent. Morphologie des fibroblastes cultivés sur a nanoplateformes non revêtues, b nanoplateformes recouvertes de nanoparticules d'argent, c nanoplateformes recouvertes d'oxyde de graphène, d nanoparticules d'argent et nanoplateformes recouvertes de composite d'oxyde de graphène. La morphologie a été évaluée par microscopie optique en utilisant un contraste de phase avec un grossissement × 200. Fibroblaste (e ) et HUVEC (f ) la viabilité après 24h d'incubation sur les nanoplateformes a été déterminée à l'aide d'un test PrestoBlue. Les valeurs sont exprimées en moyenne ± écart type (n = 3, chaque expérience en triple). La signification statistique est indiquée par différents exposants (ANOVA à un facteur ; P < 0,05). Abréviations :HUVEC, cellules endothéliales de la veine ombilicale humaine ; C, groupe témoin (feuille sans nanoparticules); AgNPs, nanoplateforme recouverte de nanoparticules d'argent ; GO, nanoplateforme recouverte d'oxyde de graphène ; Ag-GO, nanoplateforme recouverte d'un composite d'oxyde de graphène et de nanoparticules d'argent ; RU, unités relatives
La toxicité des nanoplateformes a également été évaluée à l'aide d'une membrane chorioallantoïque d'embryon de poulet (Fig. 5). Les nanoplateformes ont été incubées directement sur une membrane chorioallantoïque, et sa morphologie au point de contact a été examinée après 48h. Les AgNPs ont provoqué des changements morphologiques de la membrane chorioallantoïque, alors que dans le cas des nanoplateformes GO et Ag-GO, la morphologie était comparable à celle du groupe témoin (Fig. 5b). La membrane chorioallantoïque, après incubation sur la nanoplateforme AgNP, a montré une diminution du nombre de vaisseaux capillaires, suggérant une toxicité directe pour les cellules endothéliales et mésenchymateuses.
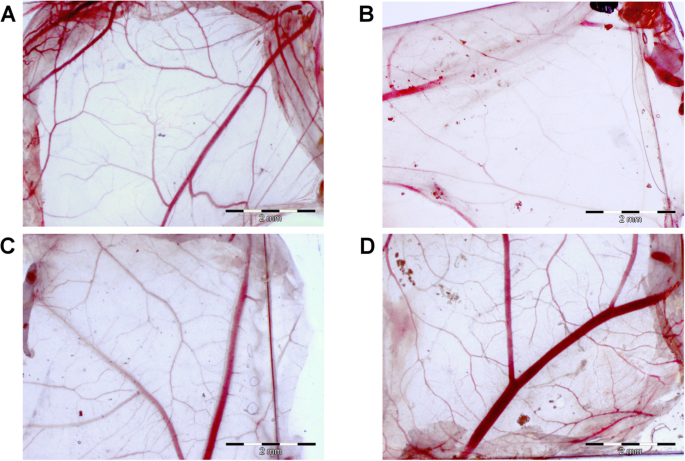
L'oxyde de graphène a diminué les changements morphologiques de la membrane chorioallantoïque causés par les nanoparticules d'argent. La morphologie de la membrane chorioallantoïque de l'embryon de poulet après 48h d'incubation avec les nanoplateformes. un Groupe témoin (feuille sans nanoparticules), b nanoplateforme recouverte de nanoparticules d'argent, c nanoplateforme recouverte d'oxyde de graphène, d nanoplateforme recouverte d'un composite d'oxyde de graphène et de nanoparticules d'argent
Les AgNP ont diminué la libération des interleukines 6 et 8
Une puce à anticorps a été utilisée pour analyser le contenu du milieu cellulaire de 40 protéines inflammatoires synthétisées par les fibroblastes (Fig. 6). Les principales protéines inflammatoires libérées par les fibroblastes étaient l'interleukine 8 (IL-8 ; Fig. 6, points :E5, F5) et l'interleukine 6 (IL-6 ; Fig. 6, points :E8, F8). Les nanoplateformes AgNP et Ag-GO ont significativement diminué le niveau de libération d'IL-8, alors que la nanoplateforme GO n'a pas eu un tel effet. De plus, les nanoplateformes GO et Ag-GO ont diminué le niveau de libération du facteur de stimulation des colonies de granulocytes-macrophages (GM-CSF ; Fig. 6, points :G5, H5). Les nanoplateformes GO et Ag-GO ont également entraîné une augmentation du niveau de libération du facteur de nécrose tumorale bêta (TNF-β ; Fig. 6, points :A9, B9). Fait intéressant, les nanoplateformes AgNP, GO et Ag-GO ont considérablement réduit le niveau de libération d'IL-6. Le niveau de libération des autres protéines analysées n'a pas été modifié. Une carte du réseau avec une liste de toutes les cytokines analysées est incluse dans le fichier supplémentaire 1 :Figure S1.
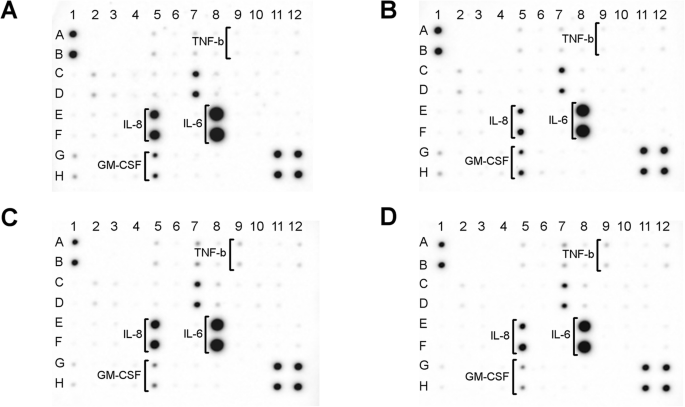
Analyse par puce à anticorps de la libération de cytokines inflammatoires des fibroblastes après 24h d'incubation. un Groupe témoin (feuille sans nanoparticules), b nanoplateforme recouverte de nanoparticules d'argent, c nanoplateforme recouverte d'oxyde de graphène, d Nanoplateforme Ag-GO recouverte d'un composite d'oxyde de graphène et de nanoparticules d'argent. Les nanoplateformes AgNP et Ag-GO ont diminué le niveau de libération d'IL-8 (points :E5, F5). Les nanoplateformes GO et Ag-GO ont toutes deux diminué la synthèse de GM-CSF (points :G5, H5). De plus, les nanoplateformes GO et Ag-GO ont conduit à une synthèse accrue de TNF-β (points :A9, B9). Les nanoplateformes AgNP, GO et Ag-GO ont diminué le niveau de libération d'IL-6 (points :E8, F8). Une carte complète du réseau est disponible dans le fichier supplémentaire 1
Discussion
Dans les applications biomédicales, la sécurité des nanomatériaux utilisés dans les matériaux antimicrobiens est aussi importante que leur efficacité à tuer les bactéries. Dans cette étude, nous avons montré que les matériaux de revêtement avec GO peuvent réduire efficacement la toxicité des nanomatériaux. Une feuille de polyuréthane recouverte d'AgNPs et de GO (Ag-GO) a non seulement augmenté leurs propriétés antimicrobiennes, mais a également diminué leur toxicité dans les cellules humaines.
La spectroscopie Raman a été utilisée pour analyser les caractéristiques structurelles de l'oxyde de graphène. La bande G dans les spectres Raman correspond à sp 2 matériau hybride à base de carbone [26]. Le pic D est lié à un défaut ou à un trouble du réseau dû à la liaison du groupe fonctionnel oxygène [27]. L'intensité de la bande D est associée à la taille du sp 2 domaines dans le plan [26]. Les bandes supplémentaires D' proviennent des défauts présents dans la structure graphitique du matériau carboné. Le rapport ID/IG (calculé à partir de l'intensité des bandes D et G) peut être utilisé pour caractériser le désordre de la structure graphitique dans les matériaux carbonés. Comme démontré, GO a une structure très désordonnée en raison de nombreux groupes fonctionnels dans la structure formés lors de l'oxydation de la poudre de graphite [28].
Le spectre FT-IR de l'oxyde de graphène collecté en mode ATR a révélé que GO a de nombreux groupes fonctionnels présents dans la structure, y compris des groupes carboxyle et époxy, des pics autour de 1720 cm − 1 et 915 cm − 1 , époxy (C–O–C) avec le pic visible autour de 1200 cm − 1 , et les liaisons C–H (pic autour de 2800 cm − 1 ). L'analyse FT-IR est en bon accord avec les mesures XPS effectuées pour GO où également des groupes hydroxyle, carboxyle, époxy et carbonyle ont été identifiés [29].
Le revêtement des nanomatériaux a été réalisé avec des technologies à ultrasons, qui se sont avérées être une méthode efficace pour revêtir divers matériaux avec des substances antibactériennes et fongicides, y compris les AgNPs [30, 31]. Les ondes ultrasonores utilisent les phénomènes de cavitation en générant et en effondrant des bulles de cavitation, produisant une énergie et une pression élevées [32]. Des nanomatériaux accélérés à des vitesses élevées entrent en collision avec le matériau enrobé et se déposent à la surface [33]. Cependant, l'efficacité du dépôt de nanomatériaux peut être augmentée non seulement en utilisant une méthode de revêtement appropriée, mais également en fabriquant des composites avec des nanomatériaux qui peuvent être plus facilement fixés à la surface. GO est un nanomatériau favorable pour créer des composites stables avec à la fois différents nanomatériaux et surfaces. En raison de sa structure unique, avec des atomes de carbone dans un motif hexagonal avec de nombreux groupes fonctionnels contenant de l'oxygène à proximité immédiate, y compris des groupes carboxyle et hydroxyle, GO est susceptible de former des liaisons covalentes ou des interactions électrostatiques [34]. Habituellement, les composites GO-nanoparticules sont synthétisés par la fixation d'ions métalliques ou de nanoparticules métalliques aux surfaces GO par le biais d'interactions électrostatiques ou covalentes. De plus, la réduction des ions métalliques et/ou GO est effectuée pour former des liaisons covalentes [35]. Les composites Ag-GO ont été fabriqués par ultrasons par réduction in situ d'Ag + [36, 37], ainsi que par le dépôt d'AgNPs [12]. Dans notre précédent rapport, nous avons montré que les méthodes ultrasonores peuvent être utilisées pour synthétiser des nanoplates-formes revêtues d'Ag-GO sur des feuilles de polyuréthane [25]. Cependant, la sonication a non seulement conduit à revêtir des feuilles de polyuréthane avec des nanomatériaux, mais également à la formation d'un composite Ag-GO. La formation du composite Ag-GO, même avant le revêtement des feuilles, aurait pu entraîner une plus grande stabilité des AgNPs après revêtement.
Dans nos études, des fibroblastes et des HUVEC ont été utilisés pour des études de cytotoxicité suivies d'une analyse de la membrane chorioallantoïque d'embryon de poulet. Les fibroblastes cutanés sont considérés comme un bon modèle pour les études d'irritation cutanée par rapport à l'analyse in vivo [38], tandis que les cellules endothéliales, y compris la cytotoxicité HUVEC, sont souvent étudiées en raison du contact direct probable des nanoparticules dans les applications biomédicales et de la sensibilité de ces cellules aux nanoparticules [ 39, 40]. La membrane chorioallantoïque d'embryon de poulet est un modèle in vivo alternatif aux modèles de rongeurs pour diverses études de toxicologie, y compris la toxicologie des matériaux et les études de toxicologie aiguë [41, 42].
Les fibroblastes et les HUVEC avaient une viabilité plus élevée lorsqu'ils étaient cultivés sur Ag-GO que sur des nanoplates-formes recouvertes d'AgNP. De plus, la nanoplateforme AgNP a provoqué des changements morphologiques dans la membrane chorioallantoïque, alors que dans le cas des nanoplateformes GO et Ag-GO, la morphologie cellulaire était comparable à celle du groupe témoin. La diminution de la toxicité sur la nanoplateforme Ag-GO pourrait résulter des effets combinés d'une plus grande stabilité des AgNPs dans le complexe avec GO et d'un meilleur dépôt d'AgNPs dans la nanoplateforme. La toxicité des cellules animales est souvent plus sévère après l'entrée des nanoparticules dans la cellule par pénétration directe ou endocytose [43]. L'endocytose des nanoparticules dépend de la taille et de la forme. Les particules plus grosses et les composites sont absorbés dans une moindre mesure que les particules d'une taille d'environ 45 nm [44]. La relation la plus notable entre l'endocytose et la forme ou la taille des nanomatériaux est caractéristique des nanotubes à paroi de carbone. Les nanotubes d'une longueur inférieure à 1 µm pénètrent efficacement dans la membrane plasmique par diffusion directe, tandis que les voies de phagocytose ou d'endocytose internalisent les nanotubes et agglomérats plus longs [45]. Récemment, le nanocomposite Ag-GO s'est avéré être internalisé par les macrophages J774, soit environ 60% de moins que les AgNPs. Cependant, comme Ag-GO induisait plus de ROS, la toxicité globale pour les cellules était plus élevée [46]. De plus, l'analyse cinétique de l'internalisation dépendante de la forme des nanoparticules montre que les nanoparticules de taille sphérique sont généralement internalisées beaucoup plus rapidement que les particules plates [47]. De plus, la toxicité des nanoparticules pour les cellules humaines dépend généralement de la taille, les particules plus petites présentant des propriétés cytotoxiques plus fortes. Dans des études sur la cytotoxicité dépendante de la taille des AgNPs pour RAW, 264,7 macrophages et nanoparticules de fibroblastes L929 avaient une viabilité plus faible après traitement avec des AgNPs 20 nm qu'après traitement avec des nanoparticules plus grosses (80, 113 nm) [13]. Par conséquent, la taille accrue des composites Ag-GO et la capacité réduite des cellules à absorber les nanoparticules résultant d'un dépôt stable à la surface pourraient être la raison de la viabilité plus élevée observée des HUVEC et des fibroblastes cultivés sur la nanoplateforme Ag-GO.
Les nanoplateformes AgNP et Ag-GO ont significativement diminué le niveau de libération d'IL-8 par les fibroblastes. Les nanoplateformes GO et Ag-GO ont conduit à une libération accrue de TNF-β. De plus, les nanoplateformes AgNP, GO et Ag-GO ont diminué la libération d'IL-6. Fait intéressant, les changements dans la synthèse des protéines pro-inflammatoires par les fibroblastes étaient liés à l'incubation des cellules sur des nanoplateformes recouvertes d'AgNPs ou de GO. Les niveaux de synthèse des cellules incubées sur Ag-GO ne différaient pas de ceux incubés sur des nanoplateformes recouvertes d'un seul de ces nanomatériaux, suggérant que l'activité biologique n'a pas changé après la synthèse du composite. Les fibroblastes sont importants dans les processus inflammatoires et de remodelage en initiant des réponses inflammatoires et en précipitant le passage de l'inflammation aiguë à la réparation tissulaire [48, 49]. Par conséquent, l'analyse des sécrétions fibroblastiques de cytokines inflammatoires est importante pour prédire la réponse immunologique aux nanoplateformes. L'IL-6 et l'IL-8 sont toutes deux l'une des cytokines inflammatoires clés qui, après synthèse par les fibroblastes, conduisent à l'activation de la réponse immunologique [50, 51]. Le niveau de synthèse des kératinocytes épidermiques humains de l'IL-6 diminue après traitement par les AgNPs [52]. De même, l'inhibition de la libération d'IL-6 par les AgNPs a été démontrée dans des cellules Jurcat et implique la voie MAPK. Les AgNP diminuent également les niveaux de synthèse du facteur de nécrose tumorale alpha (TNF-α) [53]. Le TNF-α et, de structure et de fonction très similaires, le TNF-β sont des cytokines inflammatoires qui sont importantes pendant la phase d'inflammation aiguë. Bien que les cellules immunitaires soient principalement responsables de la libération de ces protéines pendant la phase aiguë de l'inflammation, les fibroblastes et différentes cellules sont impliquées dans la synthèse des cytokines inflammatoires au cours du processus précoce de cicatrisation [54]. L'activité pour induire le TNF-α après traitement par GO a été démontrée en utilisant les macrophages RAW264.7 [55], ce qui suggère une stimulation immunologique. Cependant, dans nos études, les niveaux de libération de la plupart des protéines pro-inflammatoires analysées n'ont pas été modifiés après la culture des cellules sur les nanoplateformes GO et Ag-GO. Par conséquent, ces analyses suggèrent que les nanoplateformes GO et Ag-GO possèdent une bonne biocompatibilité et ne devraient pas conduire à de fortes réactions immunologiques.
Conclusions
En conclusion, les résultats présentés montrent que les nanoplates-formes recouvertes d'un composite Ag-GO ont montré une inhibition de croissance plus forte de S. enteritidis que les nanoplates-formes revêtues d'AgNP et de GO. De plus, le composite Ag-GO a considérablement réduit la cytotoxicité envers les fibroblastes, les HUVEC et la membrane chorioallantoïque d'embryon de poulet, par rapport aux nanoplates-formes recouvertes d'AgNPs. La viabilité cellulaire des fibroblastes et des HUVEC n'a pas été modifiée lorsqu'ils ont été incubés sur des nanoplateformes recouvertes de nanocomposite Ag-GO, montrant l'inhibition de la toxicité de l'AgNP. Ces résultats, associés à une faible stimulation immunologique, suggèrent que le GO pourrait être utilisé pour réduire la cytotoxicité de différents nanomatériaux dans les nanocomposites. De plus, les résultats suggèrent que la nanoplateforme Ag-GO pourrait être envisagée pour une utilisation dans des applications biomédicales. Cependant, des études supplémentaires sont nécessaires pour évaluer la nanoplateforme Ag-GO pour des applications spécifiques, y compris les pansements.
Matériaux et méthodes
Préparation et caractérisation de nanoplateformes recouvertes de nanomatériaux
Des nanoplateformes fabriquées à partir de feuilles de polyuréthane recouvertes de nanoparticules ont été préparées comme décrit précédemment [25]. Des feuilles de polyuréthane de forme carrée (15 × 15 mm, 0,05 mm d'épaisseur) ont été recouvertes de suspensions d'AgNPs (HydroSilver1000, Amepox, Łódź, Pologne) synthétisées par réaction de réduction chimique en présence d'alcool polyvinylique développé par Amepox et/ou GO synthétisé par méthode de Hummers modifiée. Dix grammes de poudre de graphite ont été mélangés avec 230 ml d'acide sulfurique concentré (98 %) (Sigma-Aldrich Co., St. Louis, MO, USA) à une température inférieure à 10°C. Par la suite, 4,7 µg de nitrate de sodium (Sigma-Aldrich) et 30 µg de permanganate de potassium (Sigma-Aldrich) ont été ajoutés au mélange de graphite, tout en maintenant la température en dessous de 10°C. Ensuite, le mélange a été chauffé à 30 °C et agité pendant 2 h. Ensuite, 100 ml d'eau ont été ajoutés et le mélange a été traité avec 10 ml de peroxyde d'hydrogène. GO a été purifié par filtration et lavé avec de l'eau désionisée jusqu'à ce que le pH du filtrat atteigne 6,5. Des suspensions de GO, AgNPs et le composite d'AgNPs et GO (Ag-GO) ont été préparés dans de l'eau déminéralisée. Lors de l'enrobage, les concentrations de nanomatériaux étaient les suivantes :GO, 200 mg/l; AgNPs, 100 mg/l; Ag-GO, 200 mg/l; et AgNPs, 100 mg/l. Le revêtement de nanoparticules a été réalisé à l'aide d'un cornet à ultrasons (corne Ti, Ø13 mm, efficacité 60%, 20 kHz; Sonics &Materials, Inc., Newtown, CT, USA) à une température de 30 ± 1 °C. Les échantillons couverts ont été rincés dans de l'eau désionisée et séchés dans des conditions stériles. La caractérisation des nanoplates-formes avec un microscope électronique à balayage (SEM), un microscope à force atomique (AFM) et un microscope à force latérale (LFM) a déjà été rapportée, montrant des nanoplates-formes presque entièrement recouvertes de nanomatériaux [25].
Les nanomatériaux utilisés pour obtenir les nanoplates-formes ont été imagés à l'aide d'un microscope électronique à transmission (MET). Les images MET ont été acquises à l'aide d'un microscope JEM-1220 (JEOL, Tokyo, Japon) à 80 kV avec un appareil photo Morada 11 mégapixels (Olympus Corporation, Tokyo, Japon). Les échantillons ont été préparés en plaçant des gouttelettes d'hydrocolloïdes sur des grilles de cuivre revêtues de formvar (Agar Scientific, Stansted, Royaume-Uni), qui ont été séchées à l'air avant les observations.
Les spectres Raman ont été collectés à l'aide d'un spectromètre Renishaw inVia avec une source laser de 532 nm (Wotton-under-Edge, Royaume-Uni). Pour éviter l'échauffement de l'échantillon, la puissance laser a été maintenue faible (0,3 µmW, calibrée sur l'échantillon). Le mode de cartographie Raman a été utilisé avec une zone de balayage d'environ 10 x 10 μm, contenant 25 spectres). Chaque spectre se compose de deux bandes principales, une bande G (~ 1578 cm − 1 ) et bande D (~ 1347 cm − 1 ), a été ajusté en utilisant la forme de la ligne lorentzienne. Les mesures FT-IR ont été effectuées à l'aide d'un spectromètre Nicolet iS10 (Thermo Fisher Scientific, Waltham, USA) en mode de réflectance totale atténuée sur un cristal de diamant. La suspension d'oxyde de graphène a été séchée sur la surface de polyéthylène à température ambiante pour créer une feuille mince GO. Le spectre a été collecté dans la plage 400-4000 cm − 1 .
Les mesures du potentiel zêta de GO (20 mg/l), AgNPs (10 mg/l) et Ag-GO (GO 20 mg/l et AgNPs 10 mg/l) ont été réalisées avec un Nano-ZS90 Zetasizer (Malvern Instruments, Malvern , UK) at 25 °C, using the Smoluchowski approximation. Nanomaterials were sonicated for 30 min and zeta potential was immediately measured. Subsequently, nanomaterials were left for 24 h at room temperature and the zeta potential was measured again. Each measurement was repeated at least seven times after 60 s of stabilisation at 25 °C.
The hydrodynamic diameter of nanoparticles in water and their size distribution were measured with dynamic light scattering (DLS) using a Nano-ZS90 Zetasizer (Malvern). Similar to for the zeta potential analysis, GO (20 mg/l), AgNPs (10 mg/l) and Ag-GO (GO 20 mg/l and AgNPs 10 mg/l) were sonicated for 30 min and left for 24 h at room temperature. Each sample was measured at least seven times at 25 °C.
Bacterial Cultivation
Salmonella enteritidis subspecies enterica serovar Enteritidis (ATCC 13076) was obtained from LGC Standards (Łomianki, Poland). The bacteria were grown on tryptic soy agar (Merck Millipore, Darmstadt, Germany). The bacteria, grown on agar plates, were harvested by gently washing the plates with sterile distilled saline solution. To calculate the number of bacteria in the cell suspension, the optical density of the suspensions at 600 nm (OD600) was measured using a spectrophotometer (Helios Epsilon, Unicam, Milwaukee, WI, USA). A calibration curve was prepared by performing serial tenfold dilutions of bacterial suspensions of a known optical density, up to 10 − 5 . After 24 h of incubation at 37 °C, the number of formed colonies was enumerated and the number of colony-forming units (CFU) of the original bacterial suspension was calculated.
Bacteria Viability Assay
Viability was evaluated using a PrestoBlue Cell Viability Assay (Thermo Fisher Scientific). Bacteria were cultured onto foils coated with GO, AgNPs and Ag-GO, located on inserts inserted into six-well plates (200 μl MH broth with 5 × 10 3 CFU per foil) and incubated for 24 h. Subsequently, 90 μl of each sample was transferred to 96-well plates and 10 μl of PrestoBlue reagent was added to each well and incubated for an additional 2 h at 37 °C. The optical density of each well was recorded at 570 nm using a microplate reader (Infinite M200, Tecan, Durham, NC, USA). Bacteria viability was expressed as the relative value after substitution of the absorbance from the blank samples. Experiments were repeated three times.
Scanning Electron Microscopy Analysis
Bacteria were incubated on foils with Ag-GO and a sterile cover glass. Bacteria cultures (100 μl, 10 6 CFU/ml) were incubated on foils and a cover glass for 24 h at 37 °C. Tous les échantillons ont été séchés et recouverts d'or. Cells were fixed with 2.5% glutaraldehyde in phosphate-buffered saline (PBS, pH 7.2) and contrasted with 1% osmium tetroxide (Sigma-Aldrich) and 1% carbohydrazide (Sigma-Aldrich). Subsequently, cells were dehydrated in increasing concentrations of hexylene glycol (Sigma-Aldrich). Drying was performed using a Polaron CPD 7501 critical point dryer (Quorum Technologies, Laughton, UK). Finally, the samples were imaged with a SEM (FEI Quanta 200, Tokyo, Japan) at an acceleration voltage of 15 kV.
Human Cell Lines
Human umbilical vein endothelial cells (HUVECs; catalogue number:C0035C) and human fibroblasts (catalogue number:C0135C) were obtained from Thermo Fisher Scientific. HUVECs were maintained on low-serum Medium 200 basal media supplemented with Large Vessel Endothelial Supplement (Thermo Fisher Scientific) and 1% penicillin/streptomycin (Thermo Fisher Scientific), whereas fibroblasts were cultured in low-serum Medium 106 (Thermo Fisher Scientific) supplemented with Low Serum Growth Supplement (Thermo Fisher Scientific) and 1× penicillin/streptomycin (Thermo Fisher Scientific). Cells were maintained at 37 °C in a humidified atmosphere of 5% CO2 /95% air.
To analyse biological interactions, the nanoplatforms were put into six-well plates. After detachment from the cell culture flask, HUVECs or fibroblasts were placed directly on the nanoplatform with 100 μl of growth media. To avoid the media drying during incubations, plates were kept in humidity chambers.
Analysis of Nanoplatform Toxicity to HUVECs and Fibroblasts
To analyse HUVEC and fibroblast viability on the nanoplatforms, cells were cultured in the droplet directly on the nanoplatforms or uncoated foil (1 × 10 4 cells in 100 μl growth media). After 24 h of incubation, cell viability was analysed using a PrestoBlue assay (Thermo Fisher Scientific). PrestoBlue reagent was incubated with assessed cells for 2 h in a cell culture incubator. Subsequently, 50 μl of growth media with PrestoBlue reagent was transferred to a 96-well plate where fluorescence (excitation λ = 560 nm, emission λ = 590 nm) was analysed using a Tecan Infinite 200 microplate reader (Tecan, Durham, USA). Cell viability was expressed as the relative value after substitution of the fluorescence from blank samples. Experiments were repeated three times.
Fibroblast morphology was observed using an inverted optical microscope (Olympus Corporation) using phase contrast. Fibroblasts were seeded in 35-mm diameter Petri dishes directly on the nanoplatforms (1 × 10 4 cells in 100 μl growth media). Images were taken after 24 h of incubation.
Chorioallantoic Membrane Assay
Fertilised eggs from Ross 308 hens were obtained from a certified hatchery and kept for 4 days at 12 °C. The eggs were cleaned, sterilised with UVC light and divided into four groups (4 × 20 eggs). Embryos were incubated at standard conditions (temperature 37 °C, humidity 60% and turned once per hour). At 8 days of embryonic development, small holes (1 cm 2 ) were made in the shell above the air space, the inner membrane was gently striped off and the nanoplatforms were placed on the chicken embryo chorioallantoic membrane. Subsequently, chicken embryos were incubated for the next 48 h, when nanoplatforms were cut out with the chorioallantoic membrane that was directly below the nanoplatform. The chorioallantoic membrane on the nanoplatforms was imaged using a stereoscopic microscope (SZX10, Olympus Corporation).
Antibody Array Analysis
An analysis of inflammation cytokines in fibroblast growth medium was performed using an antibody array (Abcam, Cambridge, UK; catalogue number ab134003). Fibroblast cells (1 × 10 4 ) were incubated on nanoplatforms coated with AgNPs, GO, Ag-GO and uncoated foil with 100 μl of media. After 24 h, 80 μl of growth medium was collected. For each experimental group, the growth medium from six foils was used for analysis. Pooled growth medium from the six experiments was centrifuged (1600 rpm for 5 min), and 500 μl of growth media was diluted in 500 μl of PBS. Therefore, 1 ml of diluted growth media was used per each analysed membrane. The assay was performed in accordance with the manufacturer’s instructions. Diluted growth media was incubated with the membranes for 24 h at 4 °C. Subsequently, antibodies conjugated with biotins were added and incubated for the next 24 h at 4 °C. In the next step, the membranes were incubated with streptavidin conjugated with horseradish peroxidase for 2 h at room temperature. Membranes were visualised after the addition of the provided horseradish peroxidase substrate using a ChemiDoc imaging system (Bio-Rad, Hercules, USA).
Statistical Analysis
Data were analysed using one-way analysis of variance with GraphPad Prism 8 (GraphPad Software, San Diego, CA, USA). Differences between groups were tested with Tukey’s HSD post hoc tests. Results are shown as means with standard deviations. Differences at P < 0.05 were considered significant.
Disponibilité des données et des matériaux
The datasets used and/or analysed during the current study are available from the corresponding author on reasonable request.
Abréviations
- Ag-GO:
-
Composite of silver nanoparticles and graphene oxide
- AgNPs:
-
Silver nanoparticles
- CFU :
-
Colony-forming units
- DLS :
-
Diffusion dynamique de la lumière
- FT-IR :
-
Spectroscopie infrarouge à transformée de Fourier
- GM-CSF:
-
Granulocyte-macrophage colony-stimulating factor
- GO :
-
Oxyde de graphène
- HUVECs:
-
Human umbilical vein endothelial cells
- IL-6:
-
Interleukin 6
- IL-8:
-
Interleukin 8
- SEM :
-
Microscope électronique à balayage
- TEM :
-
Microscope électronique à transmission
- TNF-α:
-
Tumour necrosis factor alpha
- TNF-β:
-
Tumour necrosis factor beta
Nanomatériaux
- Préparation de nanoparticules mPEG-ICA chargées en ICA et leur application dans le traitement des dommages cellulaires H9c2 induits par le LPS
- Synthèse biogénique, caractérisation et évaluation du potentiel antibactérien de nanoparticules d'oxyde de cuivre contre Escherichia coli
- Synthèse facile de composite CuSCN coloré et conducteur revêtu de nanoparticules CuS
- Cibler les cellules endothéliales avec des nanoparticules GaN/Fe multifonctionnelles
- Biosécurité et capacité antibactérienne du graphène et de l'oxyde de graphène in vitro et in vivo
- Promotion de la croissance cellulaire SH-SY5Y par des nanoparticules d'or modifiées avec de la 6-mercaptopurine et un peptide pénétrant dans les neurones
- Aptitude verte dans la synthèse et la stabilisation des nanoparticules de cuivre :activités catalytiques, antibactériennes, cytotoxiques et antioxydantes
- Saponines de Platycodon de Platycodi Radix (Platycodon grandiflorum) pour la synthèse verte de nanoparticules d'or et d'argent
- Nanocomposites à base d'oxyde de graphène décorés de nanoparticules d'argent en tant qu'agent antibactérien



