Fabrication et caractérisation d'oxyde de graphène fonctionnalisé à la taurine avec du 5-fluorouracile en tant que systèmes d'administration de médicaments anticancéreux
Résumé
Récemment, les systèmes de nanosupports pour les médicaments anticancéreux, en particulier les systèmes d'administration de médicaments à base de GO, sont devenus une aubaine pour les patients cancéreux. Dans cette étude, nous avons choisi Tau pour fonctionnaliser la surface GO afin d'améliorer sa biocompatibilité. Premièrement, le GO à l'échelle nanométrique a été synthétisé par la méthode de Hummer modifiée et la méthode de décapage par ultrasons. Le support d'oxyde de graphène modifié par la taurine (Tau-GO) a été synthétisé par méthode chimique pour obtenir Tau-GO qui a une bonne dispersibilité et stabilité dans l'eau, avec un potentiel zêta de − 38,8 mV et une taille de particule de 242 nm. Sur la base des critères d'évaluation de l'efficacité d'encapsulation, la formulation optimale a été déterminée pour combiner Tau-GO et 5-FU par liaison non covalente. Le 5-FU-Tau-GO était plus stable en milieu neutre qu'en milieu acide, et avec une certaine réponse du pH et un effet de libération prolongée. In vivo, nous avons comparé les administrations orale et intraveineuse de 5-FU et de 5-FU-Tau-GO, respectivement, en utilisant des tests pharmacocinétiques et des paramètres associés et avons montré que l'administration orale ou intraveineuse de 5-FU-Tau-GO prolonge le temps d'action de 5 -FU dans le corps et améliore sa biodisponibilité. De plus, l'inhibition des cellules HepG2 qui a été mesurée par le test MTT, a montré que la CI50 la valeur du 5-FU était de 196 ± 8,73 μg/mL, et l'IC50 La valeur du 5-FU-Tau-GO était de 65,2 ± 0,7 μg/mL, ce qui indique que le 5-FU-Tau-GO est plus puissant contre les cellules HepG2 et a un effet inhibiteur plus fort sur les cellules cancéreuses. L'effet sur la morphologie cellulaire qui a été mesuré à l'aide de la coloration AO/EB a également montré que le 5-FU-Tau-GO non seulement perturbait les cellules, mais induisait également de manière significative l'apoptose par rapport au 5-FU. Nous avons également vérifié par conception assistée par ordinateur que Tau-GO peut mieux se lier au 5-FU qu'au GO non modifié, et que le système 5-FU-Tau-GO formé est plus stable, et propice au transfert et à la libération du 5- UF in vivo.
Introduction
La chimiothérapie est encore une méthode courante qui est utilisée dans le traitement de divers cancers [1]. Un obstacle important de la plupart des agents chimiothérapeutiques est leur incapacité à pénétrer les tissus tumoraux, à des concentrations efficaces, ou leurs effets secondaires indésirables sur les tissus normaux [2]. Par conséquent, les scientifiques ont concentré leurs efforts sur le développement d'un système d'administration de médicaments puissant qui peut atteindre le taux contrôlé de libération de médicaments dans les tissus tumoraux pour assurer une administration et un traitement efficaces des médicaments.
De nombreux matériaux nanométriques, notamment des liposomes [3], des polymères [4], des nanoparticules [5], des dendrimères [6], des micelles [7] et de l'oxyde de graphène [8, 9] ont été développés pour l'administration de divers médicaments. Parmi ces nanomatériaux, l'oxyde de graphène (GO) est un nouveau nanomatériau de carbone qui est chimiquement exfolié à partir de graphite oxydé et présente plusieurs propriétés physiques et chimiques fascinantes, telles que des groupes fonctionnels abondants, une grande surface spécifique, une quantité élevée de médicament et une excellente dispersion. capacité dans l'eau [10,11,12]. De plus, la plupart des résultats expérimentaux in vitro ont montré qu'une faible concentration de GO pouvait être utilisée comme substrat pour la croissance cellulaire et pour activer les cellules immunitaires. Par conséquent, GO a été largement utilisé dans le diagnostic de maladies [13], l'imagerie et le suivi des cellules cancéreuses [14], la thérapie photothermique du cancer [15], l'ingénierie tissulaire [16], l'administration ciblée de médicaments [17], et surtout, comme anti- porteur de médicaments tumoraux [18, 19]. Cependant, plusieurs groupes de recherche ont signalé qu'une concentration élevée de GO a des effets cytotoxiques évidents dans les études précliniques et cliniques. Le mécanisme par lequel GO produit des effets toxiques in vivo est le stress oxydatif et la surproduction d'espèces oxygénées réactives intracellulaires, induisant l'apoptose cellulaire et provoquant une inflammation sévère, un œdème pulmonaire et la formation de granulomes [20]. Par conséquent, il est d'une importance cruciale de résoudre le problème de la toxicité des GO.
Apparemment, la fonctionnalisation de liaisons covalentes ou non covalentes peut réduire la forte interaction hydrophobe entre GO et les cellules. Cela a été démontré par plusieurs études qui ont montré que la fonctionnalisation de GO améliore sa biocompatibilité et élimine presque sa toxicité in vivo et in vitro. Yang et al. ont étudié, pour la première fois, la biodistribution à long terme du PEG-GO conjugué de manière covalente chez la souris en utilisant une méthode de radiomarquage, et les résultats ont montré que le PEG-GO pouvait être progressivement excrété par les souris, probablement dans l'urine et les selles [21]. Zhang et al. a comparé le GO fonctionnalisé DEX avec le GO et a constaté que le GO-DEX pouvait réduire considérablement la toxicité cellulaire et être principalement éliminé des souris en une semaine [22]. De plus, la liaison non covalente de GO au pluronic F127 entraîne une solubilité et une stabilité bénignes dans des conditions physiologiques, ainsi qu'une faible toxicité [23]. Bien que plusieurs polymères ou molécules aient été utilisés pour fonctionnaliser les GO, des résultats significatifs ont été obtenus dans ce domaine. Cependant, des efforts sont encore nécessaires pour développer des méthodes simples pour construire un bon transporteur de médicaments à base de GO biocompatible.
La taurine (Tau) est un acide aminé semi-essentiel avec une bonne stabilité et solubilité dans l'eau. Tau peut prévenir les maladies cardiovasculaires et cérébrovasculaires, maintenir la fonction visuelle, protéger les cellules et réguler l'immunité. De nombreuses études ont proposé que Tau possède des propriétés antitumorales grâce à sa régulation positive ou négative des facteurs d'expression qui jouent un rôle important dans divers cancers, notamment les cancers du poumon, de l'estomac, colorectal et du sein [24]. Ainsi, le GO fonctionnalisé par Tau peut exercer un rôle supérieur en tant que transporteur de médicaments anti-tumoraux. Dans cet article, nous avons utilisé, pour la première fois, du Tau covalent fonctionnalisé GO en tant que nanosupport et évalué sa cytotoxicité in vitro. De plus, le 5-fluorouracile (5-FU) a été utilisé comme médicament anticancéreux chargé de manière non covalente à la surface de Tau-GO pour construire un système d'administration de médicament. Le 5-FU-Tau-GO pourrait non seulement réduire les effets secondaires sur les tissus normaux, mais également améliorer la biodisponibilité des médicaments. Par conséquent, Tau-GO a été développé avec succès en tant que nouveau nanomatériau à base de GO qui pourrait avoir d'importantes applications biomédicales à l'avenir.
Expériences et méthodes
Matériaux
La poudre de graphite, la solution saline tamponnée au phosphate (PBS) et le diméthylsulfoxyde (DMSO) ont été achetés auprès de Tianjin Laibo Chemical Co., Ltd.; Carbodiimide (EDC), N-hydroxysuccinimide (NHS), acide chlorhydrique (HCl) et peroxyde d'hydrogène (H2 O2 30 %) ont été achetés auprès de Shandong Yuwang Industrial Co., Ltd. ; La taurine (Tau), le 5-fluorouracile (5-FU), les cellules d'hépatome humain (HepG2), la solution de pénicilline-streptomycine et le sérum de veau fœtal (FBS) ont été achetés auprès de Dalian Meilun Biotechnology Co., Ltd. ; acide sulfurique (H2 SO4 98%) et le permanganate de potassium (KMnO4 ) ont été achetés auprès de Nanjing Chemical Reagent Co., Ltd.; nitrate de sodium (NaNO3 ) et le dodécyl sulfate de sodium (SDS-Na) ont été achetés auprès de Shanghai Jinjinle Industrial Co., Ltd.; MTT a été acheté auprès de Sigma-Aldrich, Inc; Le DMEM a été acheté auprès de HyClone, Inc; Les rats ont été achetés au Benxi Changsheng Experimental Animal Center. Tous les autres réactifs et produits chimiques étaient analytiquement purs et disponibles dans le commerce.
Synthèse GO
Le GO a été préparé à partir de poudre de graphite selon une méthode modifiée de Hummer. Tout d'abord, 168 mL d'acide sulfurique à 98 % ont été ajoutés le long de la paroi d'un ballon à trois cols placé dans un bain de glace avec thermomètre, et 5 g de graphite et 4 g de nitrate de sodium ont été ajoutés lorsque la température a atteint 5 °C. Ensuite, 22,5 g de permanganate de potassium ont été ajoutés lentement par lots pendant 1 h et la température a été maintenue en dessous de 5 °C. Après cela, le ballon à trois cols a été transféré dans un bain d'huile et le mélange obtenu a été mis à réagir à 35 °C pendant 30 min, puis la température a été augmentée à 65 °C et la réaction a été agitée pendant 30 min. Après cette étape, la température a été augmentée à 85 °C et le mélange a encore été mis à réagir pendant 1 h pour obtenir une pâte brun violet. Ce mélange a été laissé au repos pendant 1 semaine, transféré dans un bécher avec 700 ml d'eau chaude, et le peroxyde d'hydrogène à 30% a été ajouté goutte à goutte jusqu'à ce qu'il devienne brun jaunâtre. Le mélange a été centrifugé à 10 000 tr/min, lavé à l'eau chaude et ce processus a été répété plusieurs fois jusqu'à ce que le pH du surnageant soit de 7,0. Enfin, le produit a été séché dans un lyophilisateur sous vide et le nano GO a été obtenu.
Synthèse Tau-GO
Un GO de 50 mg, pesé avec précision, a été dissous dans 50 mL d'eau distillée, et 150 mg d'EDC et 100 mg de NHS ont été ajoutés pour activer le GO par ultrasons dans un bain d'eau glacée pendant 20 min. Ensuite, 10 mL de solution aqueuse de Tau (0,1 g/mL) ont été ajoutés lentement (goutte à goutte) dans la solution aqueuse de GO préparée, et le pH a été ajusté à 6-7 par HCl et agité en continu pendant 24 h à la pièce dans l'obscurité. Le produit a été récupéré par centrifugation à 5000 tr/min pendant 10 min et lavé 3 fois avec de l'eau distillée. Le Tau-GO a été récupéré après lyophilisation.
Chargement 5-FU
Une quantité de 20 ml de solution de Tau-GO a été ultrasonique pendant 2 h. Une quantité pesée avec précision de 5-FU a été dissoute dans une quantité appropriée d'eau distillée, et ajoutée lentement goutte à goutte à la solution de Tau-GO préparée sous agitation à température ambiante, puis soniquée à 30 °C dans l'obscurité pendant 1,5 h. Les produits ont été centrifugés à 5000 tr/min pendant 10 min à 4 °C. Le sédiment inférieur a été lavé avec 20 mL d'eau distillée et centrifugé (5 000 tr/min pendant 10 min à 4 °C), et le processus a été répété 3 fois. La couche inférieure a été lyophilisée, le surnageant a été placé dans un bécher, pesé le volume, la concentration en 5-FU a été déterminée par une HPLC 1200 (Agilent, USA). Les conditions de détection étaient les suivantes :colonne chromatographique :C18 (4,6 x 250 nm, 5 µm); température de la colonne : 25 °C ; phase mobile :0,1 % KH2 Bon de commande4 solution à pH 5,5; débit :1,0 mL/min ; volume d'injection :20μL; et longueur d'onde de mesure :265 nm. Le taux d'encapsulation (EE) et l'efficacité de charge médicamenteuse (LE) ont été obtenus par la formule suivante :
$$\begin{aligned} {\text{EE}}\left( \% \right) &=\frac{{M_{1} - C_{1} \times L_{1} }}{{M_{1 } }} \times 100\% \\ {\text{LE}}\left( \% \right) &=\frac{{M_{1} - C_{1} \times L_{1} }}{{ 20C_{0} + M_{1} - C_{1} \times L_{1} }} \times 100\% \\ \end{aligned}$$La dose totale de 5-FU a été enregistrée comme M1 , la concentration et le volume de 5-FU libre ont été enregistrés comme C1 et L1 , et la concentration de porteur a été enregistrée comme C0 .
Caractérisation
Pour caractériser le nanocomposite préparé, des spectres infrarouges à transformée de Fourier (FT-IR) ont été balayés de 4000 à 400 cm −1 sur le spectromètre IRAffinity-1 (Shimadzu, Japon) pour confirmer les interactions. Les spectres d'absorption UV-vis ont été enregistrés sur un spectrophotomètre à balayage UV-3600 (Shimadzu, Japon). Les échantillons ont été dissous dans de l'eau distillée et les tailles de particules, les potentiels zêta et les valeurs PDI ont été obtenus sur un instrument Nano-ZS 90 Nano (Malvern, Royaume-Uni). Les morphologies des échantillons ont été analysées à l'aide d'une microscopie électronique à transmission (MET) JEM-2100 (JEOL, Japon). Les analyses thermogravimétriques (TGA) ont été réalisées à l'aide d'un analyseur thermogravimétrique (NETZSCH, Allemagne) à une vitesse de chauffe de 10 °C/min de 0 à 800 °C sous atmosphère d'azote. La mesure XRD des échantillons a été réalisée par diffractomètre à rayons X (Bruker, Allemagne) avec un rayonnement de cuivre CuKα (λ = 1.5406 Å) dans un grand angle avec un angle de 2θ. Les mesures XPS ont été effectuées à l'aide d'une sonde Omicron ESCA avec un Al Karadiation monochromatique (Thermo, America).
Libération de médicament in vitro
La libération in vitro du médicament a été réalisée à pH 1,2 (environnements gastriques simulés), pH 6,5 (environnement de cellules cancéreuses du foie simulé) et pH 7,4 (environnement physiologique simulé) à 37 °C (température corporelle simulée), respectivement. En bref, 15 mg de 5-FU-Tau-GO ont été placés dans une membrane de dialyse, immergé dans 50 mL de solutions tampons contenant 0,1 % de SDS-Na avec un pH de 1,2, 6,5 et 7,4. Tous les échantillons ont été placés dans un bain-marie agité en continu à une vitesse de 100 tr/min et à une température de 37 °C. À des moments prédéterminés (0 min, 5 min, 10 min, 20 min, 30 min, 1 h, 1,5 h, 2 h, 2,5 h, 3 h, 4 h, 8 h, 12 h, 24 h, 48 h et 72 h), 1 mL de chaque échantillon a été prélevé et remplacé par 1 mL de solution tampon fraîche contenant 0,1 % de SDS-Na pour maintenir le même volume de milieu de libération. Le milieu libéré a été centrifugé et analysé en utilisant 1200 HPLC.
Études de cytotoxicité in vitro
Dosage MTT
Le test MTT a été utilisé pour évaluer la cytotoxicité du 5-FU, du Tau-GO et du 5-FU-Tau-GO. Brièvement, les cellules d'hépatome humain HepG2 ont été cultivées en milieu DEME, additionné de 10 % de FBS et de 1 % d'antibiotiques (solution pénicilline-streptomycine) à 37 °C dans une atmosphère humidifiée à 5 % de CO2 . Les cellules ont été ensemencées dans une plaque 96 puits à une densité de 5 × 10 3 cellules par puits contenant 100 μL de milieu DEME, additionné de FBS et d'antibiotiques. La plaque a été placée pendant 24 h dans une chambre humidifiée à 37 °C contenant 5% de CO2 . Après cela, le milieu de croissance a été retiré et rempli de 100 μL de milieu frais contenant différentes concentrations (5, 10, 20, 40, 60, 80 et 100 μg/ml) de 5-FU, Tau-GO, 5-FU- Tau-GO, respectivement. Après une incubation de 24 h, les cellules ont été traitées avec 20 μL de solution de MTT et incubées à nouveau pendant 4 h. Ensuite, le milieu a été aspiré et les cristaux de formazan ont été dissous dans 150 μL de DMSO. Enfin, les plaques de puits ont été secouées à 37 °C pendant 15 min dans un oscillateur à température constante. La densité optique (DO) de chaque échantillon a été mesurée à 570 nm à l'aide d'un lecteur de microplaques. Les expériences ont été réalisées en triple. Le taux d'inhibition cellulaire a été calculé à partir des résultats en utilisant la formule suivante :
$${\text{Cell}}\;{\text{inhibition}}\;{\text{rate}} =\frac{{{\text{OD}}_{{{\text{control}}} } - {\text{OD}}_{{{\text{traité}}}} }}{{{\text{OD}}_{{{\text{control}}}} }} \times 100\ %$$où ODcontrôle est l'absorbance obtenue par des cellules témoins non traitées, DOtraitées est l'absorbance obtenue par les cellules traitées.
Test de coloration AO/EB
Une double coloration AO/EB a été utilisée pour évaluer les changements morphologiques des cellules traitées avec 5-FU, Tau-GO et 5-FU-Tau-GO. Brièvement, des cellules HepG2 en phase de croissance logarithmique ont été ensemencées en plaque 6 puits à une densité de 10 000 cellules par puits et cultivées en incubateur à 37 °C et sous 5% de CO2 atmosphère. Après 24 h, les cellules ont été traitées avec une concentration fixe de 5-FU, Tau-GO ou 5-FU-Tau-GO, puis incubées pendant 24 h. Le milieu dans chaque puits a été retiré et les cellules ont été lavées deux fois avec du PBS. Ensuite, 1 mL de PBS additionné de 40 μL de colorants fluorescents (1 mg/mL d'AO et 1 mg/mL d'EB ont été mélangés dans un rapport de 1:1) ont été ajoutés à chaque puits et incubés pendant 10 min sans lumière. Les cellules colorées ont été observées au microscope à fluorescence et les images ont été prises au hasard.
Étude pharmacocinétique
Toutes les expérimentations animales ont été menées conformément aux politiques et principes formulés par le Comité de protection des animaux et d'éthique. Un total de 24 rats SD mâles, pesant entre 230 et 270 g, ont été à jeun pendant 12 h et répartis au hasard en 4 groupes avant l'administration du médicament. Les groupes A et B ont reçu par voie intraveineuse des solutions de 5-FU et 5-FU-Tau-GO, et les groupes C et D ont reçu respectivement des solutions orales de 5-FU et 5-FU-Tau-GO. Tous les groupes ont reçu une dose de 20 mg/kg. Après l'administration du médicament, des échantillons de sang (environ 0,5 mL) ont été prélevés dans des tubes d'anticoagulation à des moments donnés (15 min, 1 h, 2 h, 4 h, 6 h, 8 h, 12 h, 16 h, 24 h et 48 h). Les échantillons de plasma ont été séparés par centrifugation à 7 500 tr/min et à 4 °C pendant 10 min. Ensuite, 200 μL de plasma et 50 mg (NH4 )2 SO4 ont été combinés dans un tube (10 μL de solution standard interne à 40 μg/mL de 5-BrU, séchés par soufflage avec de l'azote dans un bain-marie à 40 °C, vortexés pendant 5 min et centrifugés à 10 800 tr/min pendant 3 min. Ensuite, le tube a été additionné de 900 μL de solution d'acétate d'éthyle/isopropanol (85 :15, v/v), vortexé pendant 3 min et centrifugé à 10 800 tr/min pendant 15 min. Le surnageant a été retiré et séché avec de l'azote, 100 μL de phase mobile a été ajouté et le tube a été vortexé pendant 1 min. Enfin, la solution résultante recueillie à partir du surnageant a été mesurée par 1200 HPLC.
Simulation de la dynamique moléculaire
La simulation de dynamique moléculaire est principalement utilisée pour analyser la force d'interaction entre le médicament et le porteur et le comportement de diffusion du médicament. La structure chimique du 5-FU a été construite à l'aide de Chemdraw de chem office 2014, et les structures du Tau-GO et du GO ont été réalisées dans le module Polymer and Molecule Builders à l'aide du logiciel de simulation moléculaire Materials Studio (version 7.0, Accelrys Inc. , ETATS-UNIS). Tous les composés construits ont été optimisés géométriquement sous le champ de force COMPASS II, et la conformation avec la plus faible énergie a été sélectionnée comme conformation stable. Un équilibrage NVT de 10 ps a été effectué pour chaque système. La simulation a été réalisée avec 100 ps MD pour obtenir une structure équilibrée à 298 K et 101,325 kPa avec un pas de 1 fs. Enfin, le déplacement quadratique moyen (MSD) et la densité d'énergie de cohésion (CED) ont été obtenus pour chaque système, et le coefficient de diffusion (D) a été donné par la formule suivante :
$$D =\frac{1}{2d}\mathop {\lim }\limits_{\tau \to \infty } \frac{{\text{d}}}{{{\text{d}}\tau }}\gauche[ {\gauche. {r\overrightarrow {\left( t \right)} - r\overrightarrow {\left( 0 \right)} } \right]} \right.^{2}$$où le d est la dimension du système, \(r\overrightarrow {\left( t \right)}\) et \(r\overrightarrow {\left( 0 \right)}\) sont le vecteur de position de la molécule de médicament au temps t et 0, respectivement, \(\left[ {\left. {r\overrightarrow {\left( t \right)} - r\overrightarrow {\left( 0 \right)} } \right]} \right.^{ 2}\) signifie MSD.
Résultats et discussion
Caractérisation
Le conjugué Tau-GO a été fabriqué par une liaison amide de GO et Tau. La synthèse réussie du nanocomposite a été validée par des spectres FT-IR (Fig. 1). La présence des fonctionnalités d'oxygène sur GO a été confirmée par les pics d'absorbance à -OH (~ 3405 cm −1 ), C=O (1723 cm −1 ), C=C (1628 cm −1 ) et C–OH (1391 cm −1 ). Ces résultats ont prouvé la réussite de la préparation du GO (Fig. 1a) [25]. En plus de certains pics caractéristiques GO, les nouveaux pics à 1638 cm −1 et 3427 cm −1 correspondait au groupe amide, et le 1164 cm −1 et 1085 cm −1 correspond à –SO. Le spectre Tau-GO indiquait clairement que Tau avait été fonctionnalisé sur la surface GO (Fig. 1b). Dans la Fig. 2b, le pic caractéristique de –SO3 à 1164 cm −1 était submergé par l'action des liaisons hydrogène et n'était pas visible dans les spectres FT-IR. Par conséquent, le 5-FU a été chargé avec succès sur le Tau-GO.
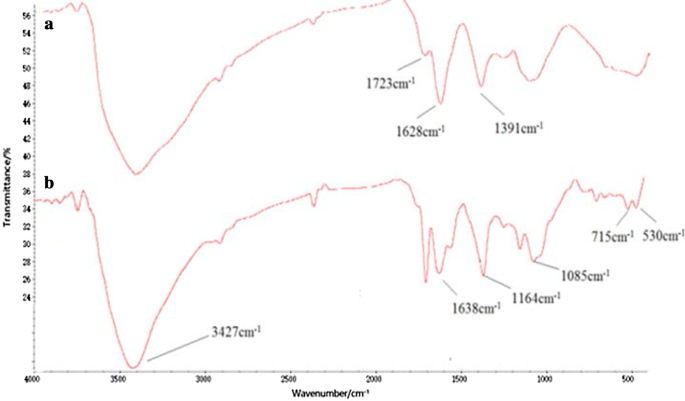
Spectres FT-IR de GO (a ) et Tau-GO (b )
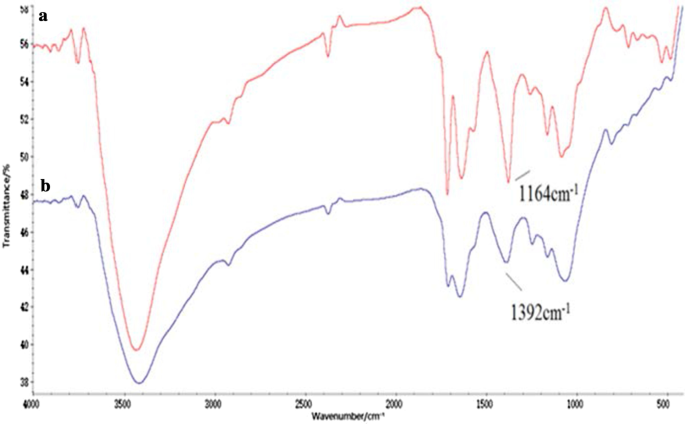
Spectres FT-IR de Tau-GO (a ) et 5-FU-Tau-GO (b )
Les spectres d'absorption GO UV-Vis sont illustrés à la Fig. 3. Le pic d'absorption évident à 234 nm a été attribué à la transition π–π* des liaisons C=C du graphène. De plus, le pic d'épaulement de 300 nm a été attribué à la transition n–π* des liaisons C=O de l'oxyde de graphène sur le groupe carboxyle ou carbonyle. Les deux pics d'absorption caractéristiques se sont avérés être des préparations réussies de GO.
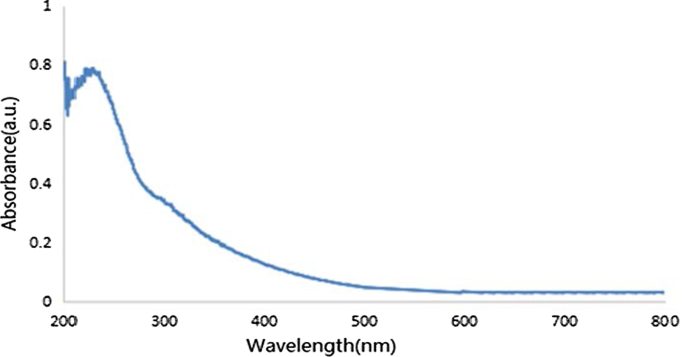
Spectres UV de GO
La taille de GO, Tau-GO et 5-FU-Tau-GO est illustrée à la Fig. 4. Le potentiel zêta de GO, Tau-GO et 5-FU-Tau-GO est illustré à la Fig. 5. La taille de les feuilles de GO étaient d'environ 221 nm et la valeur PDI était d'environ 0,188, ce qui indique que le GO préparé a une distribution uniforme et une bonne stabilité. Le potentiel zêta était d'environ − 33,3 mV, indiquant que la charge négative est principalement due à la présence de nombreux groupes contenant de l'oxygène à la surface. Lorsque le GO a été modifié avec Tau via une liaison amide, les groupes amino ont remplacé certains des groupes carboxyle et le -SO3 avait une plus forte capacité d'ionisation en solution, le potentiel zêta a diminué et est devenu − 38,8 mV. La taille et les valeurs PDI de Tau-GO étaient d'environ 242 nm et 0,190. Ensuite, le 5-FU a été chargé sur Tau-GO par une liaison non covalente. Le potentiel zêta était d'environ − 26,7 mV et la valeur absolue était supérieure à 20 mV. De plus, la taille et les valeurs PDI de 5-FU-Tau-GO étaient d'environ 264 nm et 0,182, cela indique que la répulsion électrostatique entre les particules est grande, ce qui n'est pas facile à provoquer une agrégation ou une précipitation, et que Tau a une bonne solubilité dans l'eau , GO a également une bonne solubilité dans l'eau car sa surface est modifiée par des groupes fonctionnels contenant de l'oxygène. L'utilisation du support Tau-GO pour charger le 5-FU améliore considérablement la solubilité dans l'eau du 5-FU, de sorte que le 5-FU-Tau-GO peut être dispersé de manière stable dans une solution aqueuse.
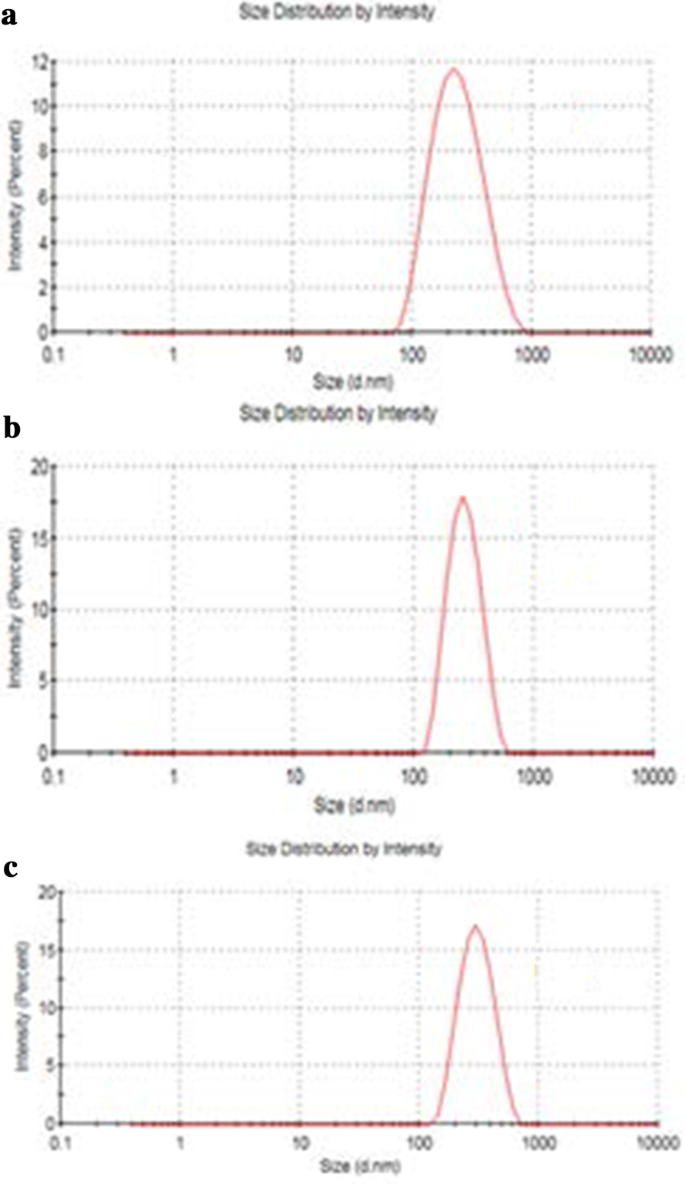
Taille des particules de GO (a ), Tau-GO (b ), et 5-FU-Tau-GO (c )
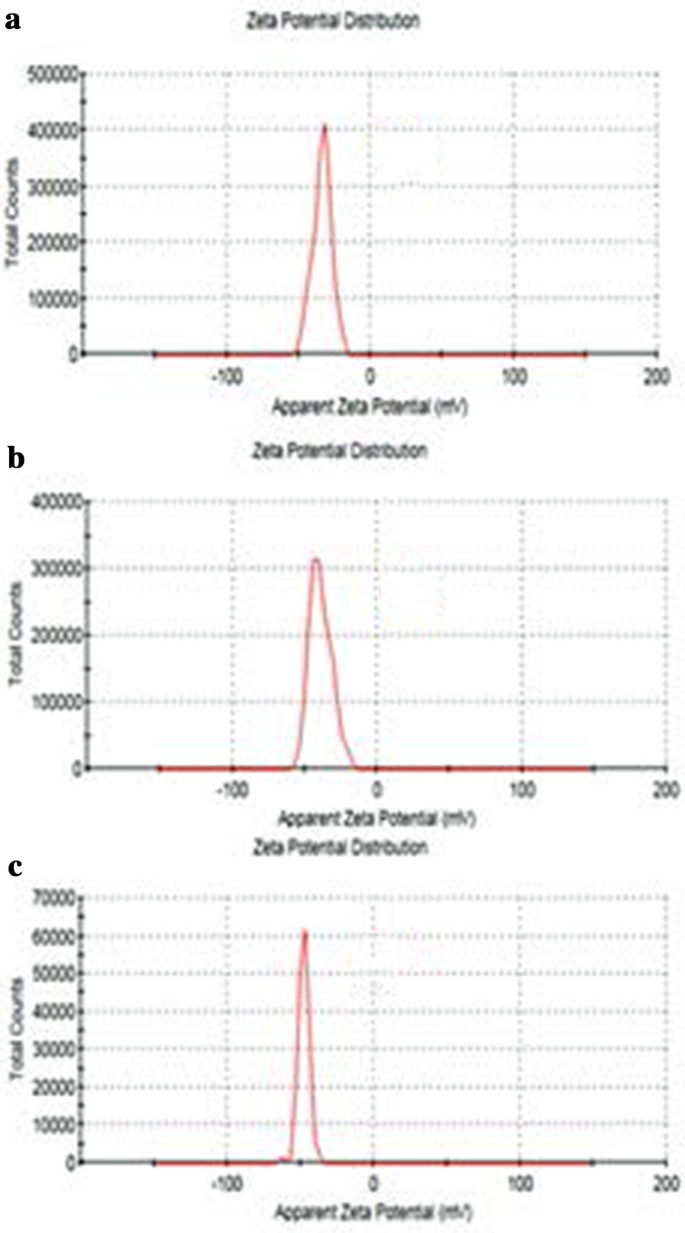
Potentiels zêta de GO (a ), Tau-GO (b ), et 5-FU-Tau-GO (c )
Les morphologies de GO, Tau-GO et 5-FU-Tau-GO ont été caractérisées par MET (Fig. 6). Le GO est une structure plate avec des rides à la surface, illustrant qu'il s'agit d'une structure bidimensionnelle plane (Fig. 6a). Par rapport à GO, la taille de Tau-GO était légèrement augmentée, mais présentait toujours une structure lamellaire (Fig. 6b). L'image 5-FU-Tau-GO a montré que les matériaux ne se sont pas agrégés ni modifiés, la structure lamellaire initiale de GO restant intacte (Fig. 6c). Par conséquent, Tau-GO et 5-FU-Tau-GO avaient une bonne stabilité.

TEM de GO (a ), Tau-GO (b ) et 5-FU-Tau-GO (c )
Une analyse thermogravimétrique a été utilisée pour quantifier les compositions des composites. Les courbes TGA de GO et Tau-GO sont illustrées à la Fig. 7. GO et Tau-GO ont des masses résiduelles de 39,73 % et 34,22 % dans une atmosphère d'azote à 800 °C. Par conséquent, lors de la comparaison des valeurs de changement de poids, la teneur en Tau dans Tau-GO a été déterminée à environ 13 %.
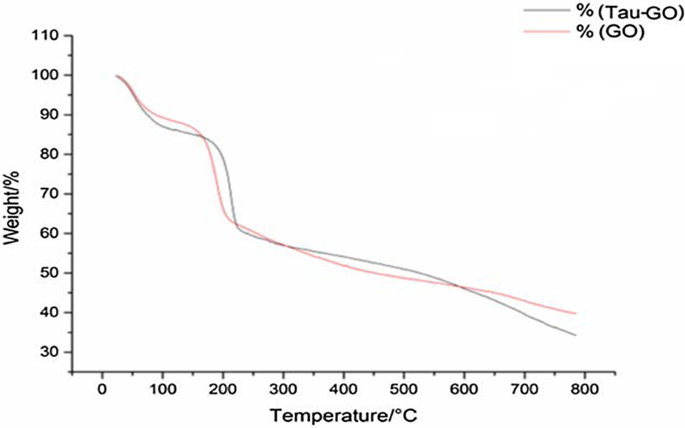
TAG de GO et Tau-GO
Les schémas XRD de Tau, GO et Tau-GO sont illustrés à la figure 8. Le pic caractéristique de GO peut être observé à 10,7° de la valeur 2θ, ce qui confirme la formation de GO avec oxydation complète pour un processus d'oxydation chimique et d'exfoliation intense. . Après fonctionnalisé avec Tau sur la surface GO, le motif de diffraction du pic a légèrement diminué à 2θ valeur 8,2. Cela signifie que GO a été fonctionnalisé avec succès par Tau.
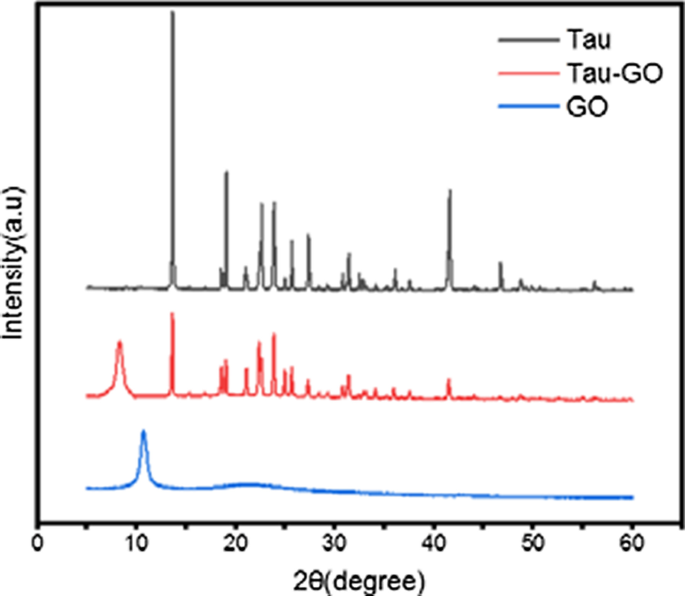
Modèles XRD de Tau, Tau-GO et GO
Les spectres C1s XPS de GO et Tau-GO sont illustrés à la Fig. 9. Les spectres C1s XPS de GO indiquent qu'il existe un degré d'oxydation considérable, avec la présence de quatre atomes de carbone correspondant à différents groupes fonctionnels. Les spectres C1s XPS de Tau-GO présentent également ces mêmes atomes de carbone. De plus, l'apparition de pics de composants liés aux liaisons C-N a été attribuée aux groupes amino et aux groupes amide. Ces résultats indiquent également que GO est fonctionnalisé avec succès par Tau.
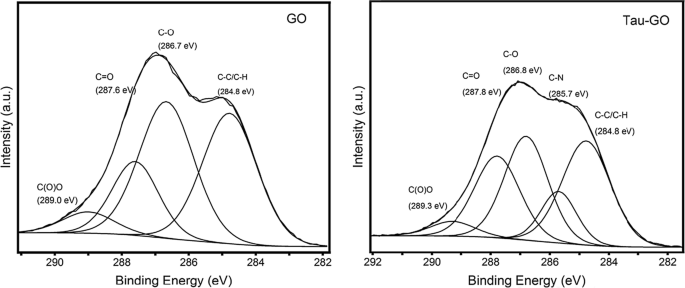
Modèles XPS C1s de GO et Tau-GO
Comportements de chargement et de libération de drogue
Le 5-FU a été adsorbé sur le nanosupport Tau-GO par des interactions non covalentes. La courbe d'étalonnage 5-FU était y = 62.135x + 21,873 (r = 0.9999), et la plage était de 6,5 ~ 250 µg/mL. Le rapport d'encapsulation (EE) et l'efficacité de chargement du médicament (LE) ont été déterminés par les concentrations de médicament non lié pour évaluer la performance de chargement du médicament. Les résultats ont montré que l'EE augmentait avec l'augmentation de la concentration du médicament et que la valeur la plus élevée de l'EE était de 83,2 %. Selon la formule, le LE était de 33,7%, soit 508,52 μg de 5-FU adsorbable sur 1 mg de Tau-GO. Par conséquent, Tau-GO est un porteur de médicament prometteur qui peut atteindre une charge importante de médicaments. Les mécanismes possibles de la capacité de chargement élevée du 5-FU sur le Tau-GO peuvent être résumés par les explications suivantes :tout d'abord, Tau est utilisé pour fonctionnaliser le GO et introduire des groupes fonctionnels actifs (–SO3 ). –SO3 a une forte capacité d'ionisation dans la solution, ce qui réduit l'agglomération entre GO et facilite le chargement de 5-FU dans Tau-GO. Deuxièmement, le potentiel Zeta du 5-FU-Tau-GO est différent de 12,1 mV de celui du Tau-GO, ce qui indique que le 5-FU est chargé à la surface du Tau-GO et que l'interaction électrostatique joue un rôle important dans la chargement de 5-FU. Enfin, il existe de nombreuses formes de liaisons hydrogène entre le 5-FU et le porteur Tau-GO, notamment -COOH dans Tau-GO et -NH- dans 5-FU, -COOH dans Tau-GO et-dans 5-FU C=O , –OH dans Tau-GO et –NH– dans 5-FU, –OH dans Tau-GO et –C=O dans 5-FU, –COOH et 5-FU dans Tau-GO –F dans Tau-GO, – COOH dans Tau-GO et -F dans 5-FU, ces liaisons hydrogène rendent le 5-FU-Tau-GO stable en solution.
La libération cumulative in vitro de 5-FU à partir du 5-FU-Tau-GO, à la température de 37 °C dans une solution de PBS à pH 1,2, 6,5 et 7,4 (simuler l'environnement gastrique, l'environnement des cellules cancéreuses du foie et l'environnement physiologique, respectivement) est illustré à la Fig. 10. Il a été constaté que le comportement libéré du 5-FU était affecté par la valeur du pH de l'environnement. Dans un tampon à pH 7,4, la libération du médicament était lente et continue, et la quantité totale de médicament libérée était d'environ 70,84 % après 72 h. En revanche, la quantité libérée de médicament à pH 7,4 était significativement inférieure à celle à pH 1,2 et pH 6,5 au même moment. La charge totale de médicament libérée par le 5-FU-Tau-GO a pu être atteinte à environ 90,29 % et 85,75 % et à pH 1,2 et pH 6,5, respectivement. Cela peut être attribué aux interactions π-π et aux liaisons hydrogène entre 5-FU et Tau-GO. Plus la valeur du pH est basse, plus le degré de protonation de la liaison hydrogène est élevé. Par conséquent, la force de la liaison hydrogène a été contrôlée par la valeur du pH, ce qui a conduit à la libération de 5-FU. Ce système d'administration de médicaments sensible au pH joue un rôle important dans les médicaments antitumoraux et peut permettre la libération des médicaments dans la cellule tumorale.
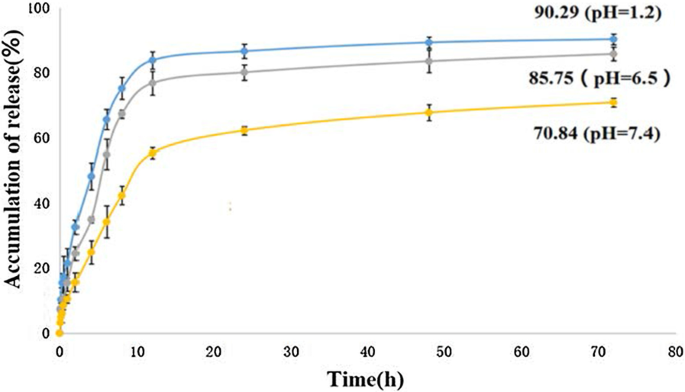
Courbes de libération in vitro du 5-FU-Tau-GO dans une solution saline de phosphate à 37 °C
Études de cytotoxicité in vitro
Pour évaluer la toxicité potentielle et l'efficacité de la thérapie tumorale du nanocarrier, la viabilité cellulaire in vitro a été réalisée dans des cellules HepG2 à l'aide de tests MTT (Fig. 11). Le Tau-GO n'a pas montré de cytotoxicité significative à différentes concentrations. Après le chargement du 5-FU, le 5-FU-Tau-GO a montré un effet d'inhibition évident et, de manière dose-dépendante, le nanosupport avait donc la capacité de délivrer des médicaments antitumoraux. L'IC50 La valeur du 5-FU-Tau-GO était de 65,2 ± 0,7 μg/mL, ce qui était plus toxique que le 5-FU libre (196 ± 8,73 μg/mL). Cela peut être dû à la capacité de la taurine à induire l'apoptose dans les cellules tumorales, augmentant ainsi indirectement l'effet inhibiteur du 5-FU sur les cellules. De plus, il a pu être vu à partir de l'expérience de libération in vitro que le 5-FU chargé sur le Tau-GO pouvait être libéré progressivement dans les cellules. Par conséquent, le temps d'efficacité du 5-FU-Tau-GO sur les cellules était plus long que celui du 5-FU libre, et a donc produit une meilleure inhibition.
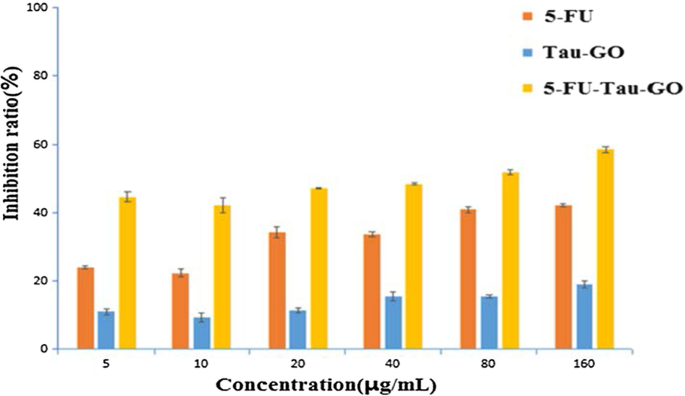
The viability of different concentrations of 5-FU, Tau-GO, and 5-FU-Tau-GO
AO fluorescent agent could emit green fluorescence when it passed through intact cell membranes and stained nuclei, while EB only marked the nucleus of damaged cells that emitted a red/orange fluorescence. The cells with early and late apoptosis presented greenish yellow or orange nuclei with the AO/EB stain, respectively. Therefore, AO/EB staining was performed to investigate whether the cells death was associated with apoptosis using characteristics of cell morphological changes. The results obtained from the AO/EB staining are presented in Fig. 12. Control cells were in spindle shape and with green nuclei. In the cell group that was cultured with Tau-GO alone, small parts of the nuclei were invaginated and with dark green or orange-red staining. Significant orange or red apoptotic cells with chromatin fragments and apoptotic bodies were observed in the 5-FU alone group. Compared with 5-FU, 5-FU-Tau-GO caused more damage to HepG2 cell morphology, which not only broke the cells, but also caused a large amount of apoptosis in cancer cells. As can be seen from the pictures, almost all the cells that were treated with 5-FU-Tau-GO, had morphological changes, a large number of cell debris and apoptotic bodies, indicating that the 5-FU-Tau-GO nano drug delivery system had a good killing effect on HepG2 cells.
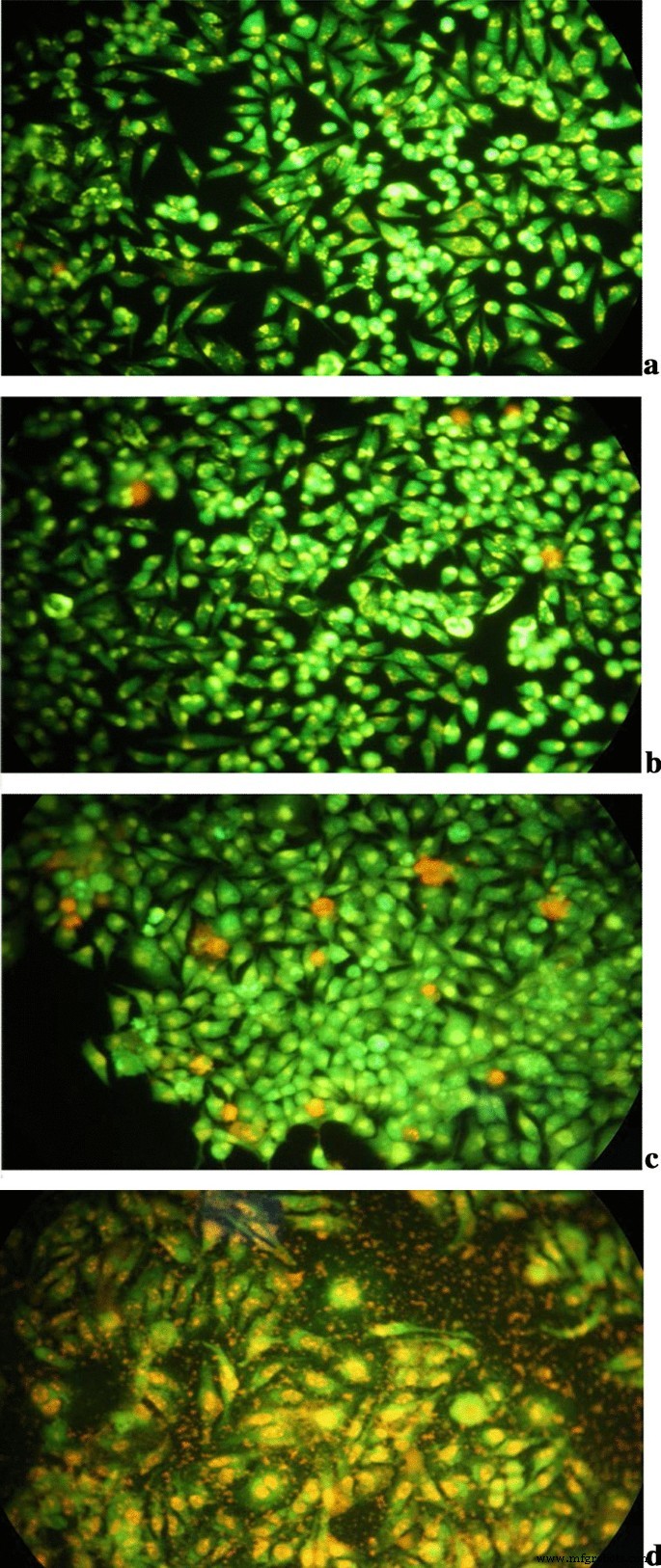
The AO/EB of control (a ), Tau-GO (b ), 5-FU (c ), and 5-FU-Tau-GO (d )
Pharmacokinetic Studies
The pharmacokinetic studies of 5-FU and 5-FU-Tau-GO were performed in SD rats. The profiles of 5-FU concentration in plasma vs. time, following oral administration, are presented in Fig. 13a. We found that the tendency of the two curves was similar, but the 5-FU plasma concentration from the 5-FU-Tau-GO nanocarrier was higher than that from the 5-FU alone and this was observed at each measured time point. Figure 13b shows the 5-FU in vivo release profiles via tail vein. The 5-FU-Tau-GO could achieve sustained drug release over 24 h, and the drug concentration gradually decreased in the first few hours, indicating that 5-FU was slowly released.
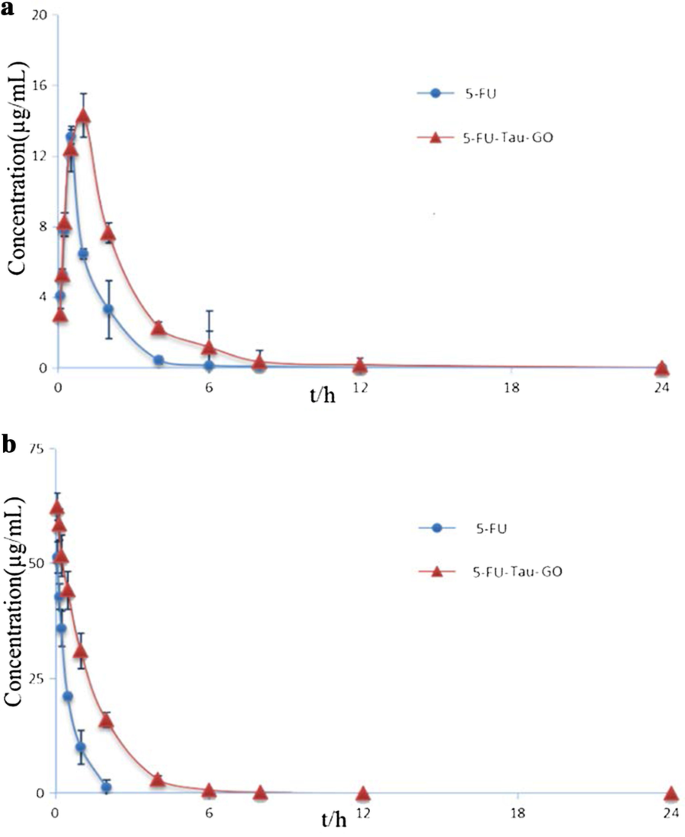
In vivo pharmacokinetic standard curves of 5-FU and 5-FU-Tau-GO through oral administration (a ). In vivo pharmacokinetic standard curve of 5-FU and 5-FU-Tau-GO through intravenous injection (b )
The two-compartment model was used to analyze the pharmacokinetic parameters of oral or intravenous administration in rats. The pharmacokinetic parameters are presented in Table 1. Compared with the 5-FU, the 5-FU-Tau-GO showed higher T1/2β that were 2.3 times by oral administration, and 3.0 times by intravenous injection, respectively. Moreover, the area under the concentration time curve (AUC0−t ) of 5-FU-Tau-GO nanocomplexes was roughy 2.1-fold higher through the oral administration, and 2.8-fold higher through intravenous injection when compared to that of the 5-FU solution, respectively. Therefore, we concluded that 5-FU-Tau-GO could significantly extend 5-FU retention time in vivo and improve bioavailability. In addition, the T1/2β of the 5-FU-Tau-GO nanocomplexes that were orally administered (1.67 ± 1.15 h), was longer than that of the intravenous injection (1.33 ± 0.64 h); however, the AUC0−t of oral administration (36.02 ± 1.83 mg/L*h) was lower than that of intravenous injection (96.50 ± 8.70 mg/L*h). These results might be due to two aspects:on the one hand, when administered by intravenous injection, the drug directly enters the blood system for circulation and without passing through the gastrointestinal barrier for redistribution; on the other hand, because 5-FU easily causes a certain damage to the gastrointestinal system, it may also affect the effective use of drugs in the body.
MD Simulations
The docking and molecular dynamics of unmodified GO, Tau-GO and 5-FU were simulated by molecular docking and molecular dynamics simulation. The molecular docking results of GO, Tau-GO and 5-FU are shown in Fig. 14, where it can be seen that the bond lengths of 5-FU and GO and Tau-GO are 3.66 Å and 2. 602 Å, respectively. Moreover, from the calculation results, the binding energies of 5-FU to GO and Tau-GO were 47.69 kcal/mol and 25.04 kcal/mol, respectively. These indicated that the binding force of Tau-GO and 5-FU was stronger than that of GO and 5-FU. This is due to Tau polar atoms, such as S and N, forming a stronger non-covalent bond with 5-FU, that makes the force between Tau-GO and 5-FU stronger.
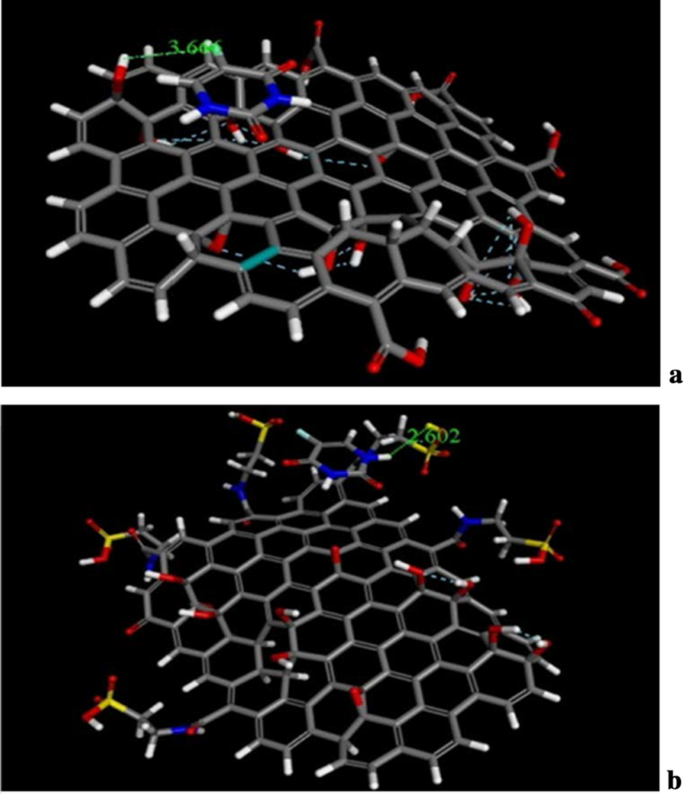
The Molecular docking of GO sheets with 5-FU (a ). The molecular docking of Tau-GO with 5-FU (b )
The diagrams of the molecular dynamics simulation of GO, Tau-GO and 5-FU were shown in Fig. 15. According to the calculation results, the CED of 5-FU-GO and 5-FU-Tau-GO were 2.67*10 8 and 2.83*10 8 , respectivement. These results showed a stronger interaction between the drug and the Tau-GO. The graphs between MSD and time were plotted (Fig. 16) to obtain the diffusion coefficient via MSD. The drug diffusion coefficients were obtained by the slope divided by 6 as follows:0.094m 2 /s and 0.058 m 2 /s. These show that the force between Tau-GO and 5-FU is stronger, which is consistent with the results of the molecular docking. Therefore, the functionalized GO makes the entire carrier more abundant in atoms and groups; Therefore, making the non-covalent bond with 5-FU stronger, and the entire system more stable.
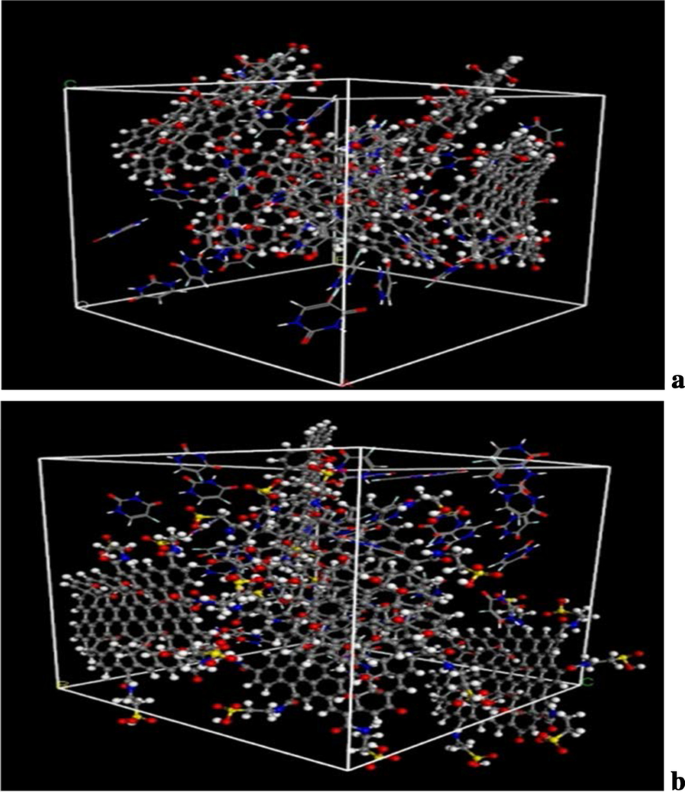
Snapshots of the GO and 5-FU at the end of the MD (a ). Snapshots of the Tau-GO and 5-FU at the end of the MD (b )
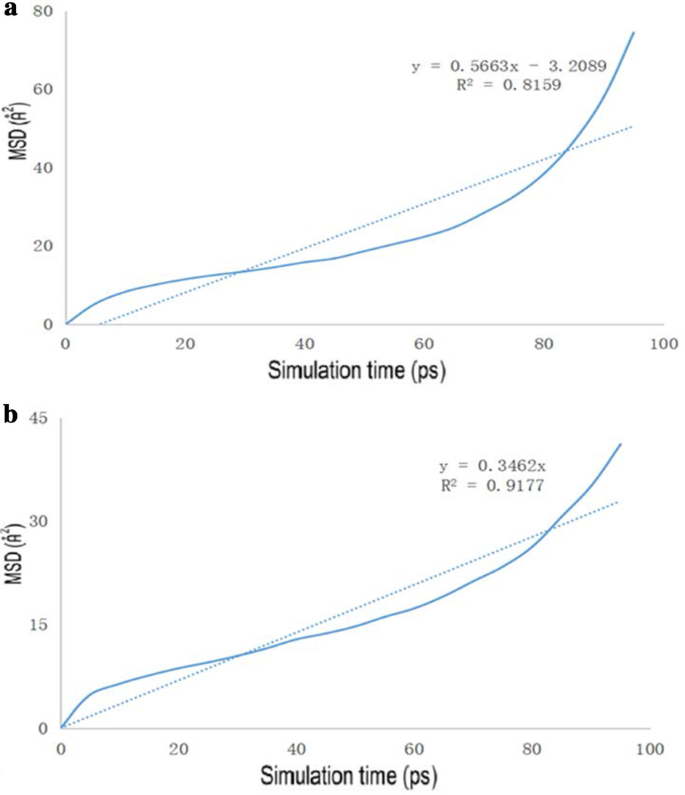
The drug MSD profiles of the GO and 5-FU (a ), Tau-GO and 5-FU (b )
Conclusions
In summary, we successfully prepared a Tau-GO nanocomposite through a simple chemical method. GO functionalization with Tau has a good stability and improves its biocompatibility. The unique structure and brilliant properties of Tau-GO nanocarriers offer great opportunities for the loading and delivery of 5-FU. The 5-FU-Tau-GO has a potential anti-tumor ability and an excellent circulation time of drugs. Therefore, we believe that the modification of GO by the carrier Tau for 5-FU loading, is an effective and applicable tool for constructing a 5-FU-Tau-GO nano drug delivery system for the delivery of anticancer drugs and anti-tumor therapy.
Disponibilité des données et des matériaux
Les ensembles de données utilisés et/ou analysés au cours de la présente étude sont disponibles auprès de l'auteur correspondant sur demande raisonnable.
Abréviations
- GO:
-
Oxyde de graphène
- Tau:
-
Taurine
- 5-FU:
-
5-Fluorouracil
- 5-FU-Tau-GO:
-
Taurine functionalized graphene oxide loading 5-fluorouracil
- EE:
-
Encapsulation ratio
- LE:
-
Drug-loading efficiency
- FT-IR :
-
Transformée de Fourier infrarouge
- TEM :
-
Microscopie électronique à transmission
- TGA :
-
Analyses thermogravimétriques
- MSD :
-
Mean square displacement
- CED:
-
Cohesive energy density
Nanomatériaux
- Nanofibres et filaments pour une administration améliorée des médicaments
- Nanoparticules FePO4 biocompatibles :administration de médicaments, stabilisation de l'ARN et activité fonctionnelle
- Nanotubes de titanate Nanocomposites d'oxyde de graphène décoré :préparation, ignifugation et photodégradation
- Biosécurité et capacité antibactérienne du graphène et de l'oxyde de graphène in vitro et in vivo
- RGO et réseaux tridimensionnels de graphène co-modifiés TIM avec de hautes performances
- Mécanisme de conduction et endurance améliorée dans la RRAM à base de HfO2 avec traitement de nitruration
- Fabrication, caractérisation et activité biologique de systèmes de nano-administration d'avermectine avec différentes tailles de particules
- Évaluation des structures graphène/WO3 et graphène/CeO x en tant qu'électrodes pour les applications de supercondensateurs
- Aérogel de graphène/polyaniline avec superélasticité et haute capacité en tant qu'électrode de supercondensateur hautement tolérante à la compression



