Oxydation catalytique sans solvant de l'alcool benzylique sur du bimétal Au-Pd déposé sur TiO2 :comparaison du rutile, de la brookite et de l'anatase
Résumé
TiO2 Les nanoparticules bimétalliques Au-Pd supportées par (P25) ont affiché d'excellentes performances dans l'oxydation catalytique de l'alcool benzylique sans solvant. Cependant, peu d'attention a été accordée à la recherche pour étudier les effets du TiO2 forme sur l'activité catalytique de Au-Pd/TiO2 . Dans la présente recherche, le rutile, la brookite et l'anatase TiO2 ont été synthétisés avec succès et ensuite appliqués comme support pour charger des nanoparticules Au-Pd par la méthode de dépôt-précipitation. Les résultats expérimentaux ont indiqué que la conversion de l'alcool benzylique utilisant le rutile TiO2 -le catalyseur Au-Pd supporté est supérieur à la conversion de l'anatase et de la brookite TiO2 -catalyseurs Au-Pd chargés. Cependant, l'Au-Pd/TiO2 -le rutile présentait respectivement la sélectivité la plus faible et la plus élevée vis-à-vis du benzaldéhyde et du toluène. ICP-AES, XRD, XPS et TEM ont été menés pour caractériser ces catalyseurs. Les résultats expérimentaux correspondants ont révélé que les excellentes performances de Au-Pd/TiO2 -le catalyseur rutile a été attribué à la fois à la plus petite distribution de la taille des nanoparticules Au-Pd et aux concentrations plus élevées de Oα et Pd 2+ espèces à la surface du catalyseur. Dans les expériences de recyclage, l'Au-Pd/TiO2 -le catalyseur rutile présentait une stabilité de réaction inférieure à celle du Au-Pd/TiO2 -anatase et Au-Pd/TiO2 -brookite, ce qui pourrait être dû à la couverture d'une plus grande quantité de produits aldéhydiques sur la surface.
Introduction
L'or a longtemps été considéré comme chimiquement inerte jusqu'à ce que Hutchings et Haruta découvrent indépendamment leurs excellentes activités catalytiques dans l'hydrochloration de l'acétylène et l'oxydation catalytique du CO à basse température, respectivement [1, 2]. L'or, en tant que composant actif, a été largement étudié dans de nombreuses réactions, y compris la réaction de conversion eau-gaz, la synthèse directe de H2 O2 de O2 et H2 , et l'hydrogénation sélective du cinnamaldéhyde [3,4,5]. En outre, la réactivité et la stabilité des catalyseurs à base d'Au pourraient être considérablement améliorées en les combinant avec du Pd. Par exemple, Hutchings et al. ont trouvé que l'activité catalytique du bimétal Au-Pd immobilisé sur TiO2 (P25) est beaucoup plus élevé que les catalyseurs Au ou Pd supportés pour l'oxydation de l'alcool benzylique en l'absence de solvant [6].
Il est généralement admis que l'activité catalytique du catalyseur bimétallique Au-Pd supporté est étroitement liée à la propriété du support, à la taille des nanoparticules et à la méthode de préparation. Comme supports de catalyseur, des oxydes métalliques réductibles tels que TiO2 , PDG2 , et Fe2 O3 ont été largement adoptés en raison de la forte interaction entre les métaux et le support, ainsi que l'activation facile de l'oxygène moléculaire. TiO2 , en tant que support candidat typique, a été largement étudié pour soutenir Au-Pd, qui a également montré l'activité catalytique exceptionnelle pour l'oxydation de l'alcool benzylique. Par exemple, Hutchings et al. d'abord préparé l'Au-Pd/TiO2 par la méthode d'immobilisation du sol et appliqué à l'oxydation catalytique sélective d'alcools en aldéhydes. Les résultats correspondants ont indiqué que l'alliage de Au avec Pd peut entraîner une augmentation de l'activité jusqu'à vingt-cinq fois par rapport au catalyseur Au, tout en conservant la sélectivité [6]. Chadwick et al. récemment préparé le bimétallique Au-Pd/TiO2 nanotubes en utilisant la synthèse colloïdale et l'immobilisation sur des nanotubes de titane sans sodium, qui ont affiché des performances catalytiques supérieures pour l'oxydation de l'alcool benzylique en benzaldéhyde [7]. Zheng et al. développé une série de Au@Pd/TiO2 catalyseurs avec Pd hautement dispersé par une méthode de photo-dépôt en deux étapes, qui a également agi comme un catalyseur hautement actif pour l'oxydation aérobie de l'alcool benzylique dans des conditions sans solvant [8]. Li et al. adopté une approche bio-réductrice avec de l'extrait de cacumen platycladi pour fabriquer Au-Pd/TiO2 puis appliqué dans l'oxydation sans solvant de l'alcool benzylique. Le catalyseur a affiché d'excellentes performances catalytiques, une durabilité et une réutilisation [9].
Le type de TiO2 le plus utilisé est P25. Cependant, il est reconnu que l'oxyde de titane contient trois formes différentes :le rutile, la brookite et l'anatase. Jusqu'à présent, on pouvait voir que l'influence de TiO2 forme sur l'activité catalytique n'a été signalée que dans les réactions photocatalytiques et les réactions d'oxydation catalytique gaz-solide, telles que le CO2 réduction photocatalytique, oxydation catalytique du CO et NH3 réduction catalytique sélective NOx [10,11,12]. Il est universellement reconnu que l'anatase TiO2 , en tant que support, présente généralement une meilleure activité catalytique que celle du rutile et de la brookite TiO2 . Néanmoins, ce point de vue est contraire à certains résultats expérimentaux. Dai et al. utilisé la méthode de dépôt-précipitation pour charger Au sur la surface de l'anatase, du rutile, de la brookite TiO2 , et P25, respectivement, et ont étudié leur activité catalytique pour l'oxydation du CO. Les résultats correspondants suggèrent que la brookite TiO2 -le catalyseur d'or supporté maintient l'activité catalytique la plus élevée en raison des plus petites nanoparticules d'Au sur la surface [11]. Yao et al. PDG préparé2 /anatase, PDG2 /brookite, et CeO2 /rutile avec la méthode traditionnelle d'imprégnation par humidité naissante et comparé leur NH3 -SCR performances catalytiques. Les résultats expérimentaux ont indiqué que les performances catalytiques optimales pouvaient être obtenues à partir du CeO2 /rutile, ce qui pourrait être dû à ses excellentes performances redox, une concentration plus élevée de sites acides, Ce 3+ et les espèces d'oxygène adsorbées sur la surface du catalyseur [12]. Li et al. a étudié le CO2 photoréduction avec vapeur d'eau sur rutile, anatase et brookite TiO2; les résultats expérimentaux ont démontré que la brookite TiO2 a montré les meilleures performances photocatalytiques par rapport à l'anatase et au rutile, ce qui est lié à la barrière énergétique de formation la plus basse de la lacune d'oxygène à la surface de la brookite [10].
Bien que Au-Pd/TiO2 catalyseur a montré l'activité catalytique exceptionnelle dans l'oxydation de l'alcool benzylique, l'influence du TiO2 -la forme Au-Pd supportée sur les performances catalytiques n'a pas été examinée jusqu'à présent. Par conséquent, il est essentiel d'effectuer des expériences comparatives pour étudier les différences d'activité catalytique et révéler les raisons des différentes performances catalytiques de TiO2 -supporté Au-Pd sur rutile, brookite et anatase TiO2 . Le présent travail a étudié l'activité catalytique de l'oxydation de l'alcool benzylique sur le bimétal Au-Pd supporté respectivement sur l'anatase, le rutile et la brookite. Pendant ce temps, XRD, ICP-AES, XPS et TEM ont été appliqués pour révéler l'effet de TiO2 forme sur les propriétés physico-chimiques de Au-Pd/TiO2 .
Méthodes
Tous les réactifs chimiques ont été achetés auprès de la société Aladdin (Shanghai, Chine) et utilisés tels que reçus :urée (99,9 % de base métallique), solution aqueuse de dihydroxyde de bis (lactate d'ammonium) de titane (à déterminer, 50 % dans l'eau), TiCl4 (base de 99,99 % de métaux), éthanol (≥ 99,5%, pureté), H2 SO4 (> 98%, pureté), PdCl2 (99,99 % sur la base des métaux), HAuCl4 ·3H2 O (≥ 99,9% sur la base des métaux traces), alcool benzylique (99,8%, pureté). O2 (99,999 %, pureté) a été fourni par la société Taiyuan Iron and Steel.
Synthèse de Brookite et Anatase TiO2 [13]
Pour préparer la brookite TiO2 , 8 mL de solution TBD (50%) et 17 g d'urée ont d'abord été mélangés, puis la solution de mélange a été ajustée à 80 mL par l'ajout de l'eau déminéralisée supplémentaire. Par la suite, la solution résultante a été transférée dans un autoclave de 200 ml revêtu de téflon, qui a été encapsulé et maintenu à 160 °C pendant 24 h. Lorsque l'autoclave a été refroidi à température ambiante, les précipités ont été filtrés, lavés et séchés. Enfin, la poudre obtenue a été calcinée à 500 °C pendant 5 h.
Pour la préparation d'anatase TiO2 , nous avons seulement ajusté le dosage d'urée de 17 à 0.48 g et répété les étapes comme indiqué ci-dessus.
Synthèse du Rutile TiO2 [10]
Pour le rutile TiO2 , la quantité requise de TiCl4 a été dissous dans de l'éthanol sous agitation. Après la formation du sol jaunâtre, de l'eau a été ajoutée à la solution ci-dessus, goutte à goutte, tout en agitant. Le rapport molaire de TiCl4 , l'éthanol et l'eau ont été contrôlés à 2:20:280. Le mélange résultant a été agité pendant encore 3 h et vieilli à 50 °C pendant 24 h dans un autoclave bien fermé. Ensuite, le précipité blanc a été centrifugé, lavé et séché. Enfin, le produit obtenu a également été calciné à 500 °C pendant 5 h.
Préparation de Au-Pd déposé sur Brookite, Anatase et Rutile
Pour garder le rapport molaire Au:Pd de 1:1, les charges nominales de Au et Pd sur Au-Pd/TiO2 les catalyseurs étaient de 1,00 % en poids et 0,54 % en poids, respectivement. 1,00 % en poids Au-0,54 % en poids Pd/TiO2 (brookite, anatase et rutile) ont été préparés par la méthode de dépôt-précipitation, avec de l'urée comme précipitant. Typiquement, pour la préparation de Au-Pd/TiO2 -brookite, 2 mL de solution aqueuse de HAuCl4 (5 mg Au/mL), 1,08 mL de solution aqueuse de PdCl2 (5 mg Pd/mL), 0,985 g de brookite TiO2 , et 3,48 g d'urée ont été ajoutés dans 100 mL d'eau déminéralisée sous agitation à température ambiante. La solution de mélange a été agitée à 80°C pendant 6 h. Ensuite, la solution obtenue a été vieillie à température ambiante pendant encore 12 h. Ensuite, le précipité a été centrifugé, lavé et séché. Enfin, le produit obtenu a été calciné à 300°C pendant 2 h avec une vitesse de chauffe de 2°C/min.
Pour simplifier, le TiO2 préparé -brookite, TiO2 -rutile, TiO2 catalyseurs -anatase Au-Pd/TiO2 -brookite, Au-Pd/TiO2 -rutile, et Au-Pd/TiO2 -les échantillons d'anatase ont été notés TiO2 -B, TiO2 -R, TiO2 -A, ATB, ATR et ATA, respectivement.
Oxydation de l'alcool benzylique
L'oxydation catalytique à l'alcool benzylique a été réalisée dans un réacteur agité mécaniquement à l'aide de miniclaves émaillés de 50 ml (Anhui Kemi Machinery Technology Co., Ltd, Chine). Typiquement, 15 mL d'alcool benzylique et 0,05 g de catalyseur ont été introduits dans le réacteur, et le réacteur a été scellé et purgé 5 fois par O2 . Par la suite, le réacteur a été pressurisé à 0.3 MPa avec O2 à température ambiante. Le mélange réactionnel a été chauffé à la température requise à 1000 rpm. Le réacteur était également relié au réservoir d'oxygène dans le but de reconstituer l'oxygène consommé pendant la réaction. Les produits de réaction ont été analysés par GC (FuLi GC9790, Zhejiang, Chine) équipé d'un détecteur à ionisation de flamme (FID) et d'une colonne DM-5 (30 m × 0,25 mm × 0,25 μm). Afin d'assurer la fiabilité des données, chaque groupe d'expériences a été répété au moins deux fois, et chaque point de données a été déterminé trois fois par GC.
Pour étudier la stabilité de l'activité catalytique, le catalyseur réutilisé a été réalisé dans trois cercles catalytiques. Après chaque essai, le catalyseur a été récupéré et lavé avec de l'acétone puis chauffé à 80 °C pendant 16 h.
Caractérisation
La XRD sur poudre a été réalisée sur un diffractomètre Rigaku D/max-RC avec un rayonnement CuKα à 40 kV et 25 mA (λ =0,15418 nm). Les intensités ont été enregistrées dans la plage de balayage de 10 à 90° à la vitesse de 8 °/min. L'ICP-AES a été réalisée pour déterminer quantitativement la composition chimique des catalyseurs préparés sur un instrument Agilent 735-ES. Avant les mesures, le catalyseur a été dissous dans l'eau régale pendant environ 24 h. Des mesures de spectroscopie photoélectronique aux rayons X ont été réalisées sur un spectromètre PHI-1600ESCA System XPS (Perkin-Elmer, USA) utilisant un rayonnement Mg-Kα non monochromatique, fonctionnant à 15 kV et sous 10 -7 Pa pression avec une énergie photoélectronique fixée à 1254 eV. Les énergies de liaison rapportées ont été référencées à l'énergie de liaison C1s de 284,6 eV. La MET a été réalisée sur un microscope électronique JEM-2100, fonctionnant à 200 kV. Avant l'analyse, de l'éthanol a été utilisé pour disperser les poudres d'échantillon à l'aide des ultrasons, puis la solution mélangée a été déposée sur une grille à mailles avec un film de carbone.
Résultats et discussion
La XRD a été réalisée pour étudier la forme cristalline du TiO2 porteurs et états de dispersion Au-Pd sur Au-Pd/TiO2 catalyseurs. Comme le montre la figure 1, dix pics de diffraction à 25,4, 37,8, 48,1, 54,1, 55,2, 62,9, 68,8, 70,4, 75,1 et 82,7° ont été détectés pour l'anatase TiO2 préparée. , qui étaient conformes à la fiche PDF standard (n° 21-1272). Il a également pu être constaté qu'une série de pics à 25,4, 30,9, 32,8, 36,3, 37,4, 40,2, 42,4, 46,2, 48,2, 49,3, 54,4, 55,3, 57,4, 60,2, 62,2, 63,8, 65,1, 66,1, 69,1, 70,7 , 77,2, 82,7 et 87,0° ont été détectés sur la brookite préparée TiO2 support, qui s'adapte bien à la carte PDF brookite standard (brookite TiO2 PDF 29-1360). Le rutile préparé TiO2 présentaient les pics correspondants à 27,5, 36,1, 39,2, 41,3, 44,2, 54,3, 56,6, 62,7, 64,1, 69,1, 69,9, 76,6, 82,4 et 84,3°, ce qui était également cohérent avec le rutile TiO2 Fiche PDF (rutile TiO2 PDF 21-1276). Les résultats XRD ci-dessus ont confirmé que TiO2 avec les formes rutile, brookite et anatase ont été préparées avec succès. Pendant ce temps, le TiO2 moyen Les tailles des cristallites ont été estimées en utilisant l'équation de Scherrer basée sur les informations des pics de diffraction à différents endroits (2θ =25,4° pour TiO2 -A, 30,9° pour TiO2 -B, et 27,6° pour TiO2 -R); les résultats calculés ont montré que la taille des nanoparticules de TiO2 ont été disposés dans l'ordre suivant :TiO2 -R (27.6 nm)> TiO2 -B (18,9 nm)> TiO2 -A (11,2 nm). Après chargement de nanoparticules bimétalliques Au-Pd sur les surfaces de TiO2 porteurs, aucun pic de diffraction attribué à Au ou Pd n'a été détecté sur le Au-Pd/TiO2 préparé motifs. Ce phénomène a non seulement indiqué que l'Au et le Pd étaient fortement dispersés dans des tailles de particules plus petites (par exemple 3~5 nm), ce qui ne peut pas être observé par le XRD, mais a également suggéré que la structure cristalline du TiO2 transporteurs n'a pas été affecté par le chargement d'Au et de Pd.
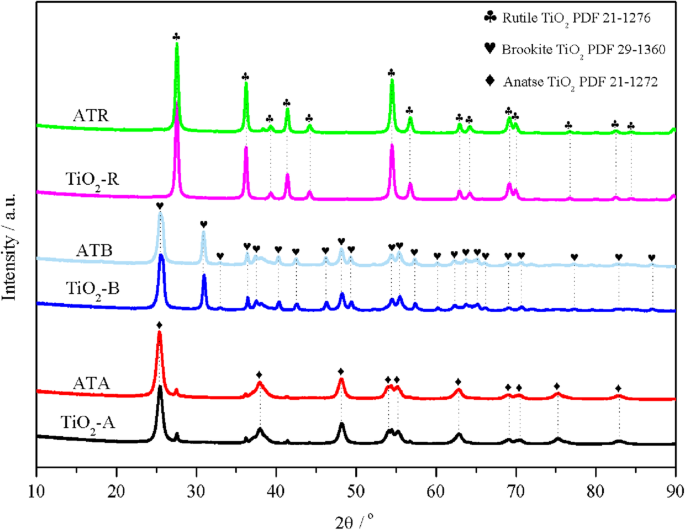
Modèles XRD du TiO2 -A, ATA, TiO2 -B, ATB, TiO2 -Échantillons R et ATR
Pour déterminer les teneurs réelles en Au et Pd sur l'Au-Pd/TiO2 préparé catalyseurs, l'ICP-AES a été menée. Les résultats correspondants sont répertoriés dans le tableau 1. Il a été constaté que les concentrations réelles de métaux en vrac étaient inférieures aux valeurs nominales, ce qui pourrait avoir été causé par la lixiviation de nanoparticules Au-Pd faiblement adsorbées pendant le processus de filtration ou de lavage.
XPS, en tant que technique de sonde sensible à la surface, a été réalisée pour détecter la composition des éléments de surface et les états chimiques. La figure 2 présentait les spectres Au (4f), Pd (3d), O (1 s) et Ti (2p) pour les nanoparticules Au-Pd supportées sur TiO2 catalyseurs. Comme le montre la figure 2.1, les spectres Au 4f ont été détectés à deux emplacements sur chaque catalyseur, mais les positions spécifiques des deux pics étaient légèrement différentes. Il est généralement admis que le spectre Au 4f à l'état métallique présente généralement deux contributions (4f7/2 et Au 4f5/2 ), qui se situaient respectivement à 84,0 et 87,7 eV [14]. Le décalage négatif observé des spectres Au 4f pour ces trois Au-Pd/TiO2 Les catalyseurs pourraient être expliqués par la modification électronique des espèces Au par les espèces Pd, ce qui suggère également la forte interaction entre les espèces Au et Pd. De plus, aucune espèce Au ionique n'a été détectée sur le Au-Pd/TiO2 préparé catalyseurs.
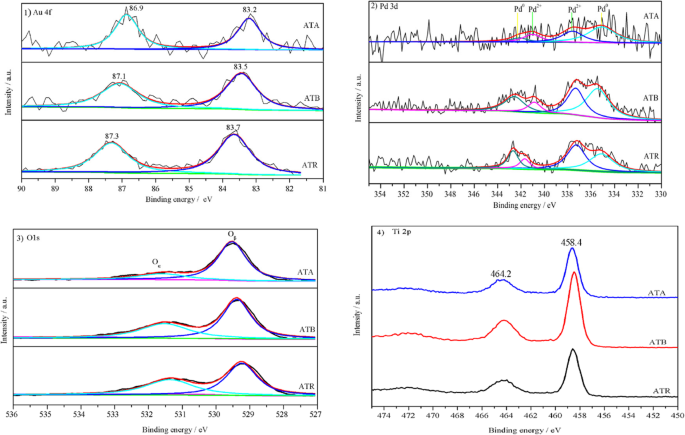
Spectres XPS de (1 ) Au 4f , (2 )Pd 3d, (3 ) O1s, et (4 ) Ti 2p) pour les échantillons ATA, ATB et ATR
La figure 2.2 a montré les spectres XPS des régions de niveau central Pd 3d des échantillons ATA, ATB et ATR. Selon les rapports précédents, les bandes de Pd 3d pourraient être déconvoluées en quatre sous-pics; le Pd 3d3/2 et 3d5/2 les pics aux alentours de 335 et 341 eV sont attribués au Pd 0 métallique [15], le Pd 3d5/2 et 3d7/2 centrés à environ 337 et 342 eV sont attribués au Pd 2+ [16]. Évidemment, Pd 0 et Pd 2+ coexistaient à la surface du catalyseur, d'après les résultats de l'analyse. Les pourcentages de Pd 2+ espèces sur Au-Pd/TiO2 les catalyseurs ont été obtenus par des zones de montage XPS Pd 2+ /(Pd 2+ +Pd 0 ). Le contenu de Pd 2+ sur la surface du catalyseur ont été disposés dans l'ordre suivant :ATR (55,4 %)> ATB (48,2 %)> ATA (34,8 %). Il est généralement admis que la formation de Pd 2+ espèces à la surface du catalyseur est étroitement liée aux processus de séchage et de calcination [17]. Néanmoins, les ratios plus élevés de Pd 2+ sur l'ATR et l'ATB ont indiqué que le TiO2 transporteur a également joué un rôle essentiel dans la promotion de la formation de Pd 2+ , qui pourrait fournir de l'oxygène pour aider à la production de Pd 2+ . L'existence de Pd 2+ l'espèce démontre en outre que certains Pd ne peuvent pas s'allier avec Au; ce phénomène a été rapporté dans le même Au-Pd/CeO2 catalyseur [18].
Les spectres XPS des O1 sur les catalyseurs ATA, ATB et ATR sont présentés sur la figure 2.3. Comme indiqué, le pic O1s peut être intégré à deux sous-pics. La sous-bande à l'énergie de bande inférieure (529.1 eV) peut être attribuée à l'oxygène du réseau (Oβ ) et la sous-bande à l'énergie de liaison la plus élevée (531,0 eV) peut être attribuée à l'oxygène adsorbé en surface (Oα ). Dans les réactions d'oxydation catalytique traditionnelles, l'oxygène adsorbé en surface présente généralement une réactivité plus élevée que l'oxygène du réseau, en raison de sa mobilité plus élevée [19]. Par conséquent, le Oα ratios sur ces trois Au-Pd/TiO2 les catalyseurs ont été calculés par les zones de montage XPS Oα /(Oα +Oβ ). Il a été constaté que le Oα le ratio sur l'ATR (43,8%) est supérieur à l'Oα ratio sur l'ATB (38,7 %) et l'ATA (20,2 %). Le Oα peut également être appliqué pour estimer les teneurs en lacunes d'oxygène à la surface du catalyseur, qui jouent un rôle clé dans la stabilisation des nanoparticules Au-Pd sur le catalyseur et la promotion de l'activité catalytique. Le Oα les ratios sont cohérents avec le Pd 2+ concentrations à la surface du catalyseur. La figure 2.4 présente les spectres Ti2p XPS. Les pics sont centrés à environ 464,2 et 458,4 eV; cela pourrait être attribué au Ti 2p1/2 et Ti 2p3/2 de Ti 4+ en TiO2 , respectivement, indiquant que Ti était à l'état d'oxydation de +4 [20].
Les concentrations atomiques de surface obtenues à partir des résultats de la caractérisation XPS sont résumées dans le tableau 2. Par rapport aux compositions en vrac Au-Pd déterminées par ICP-AES, on peut constater que la teneur en Au à la surface de l'Au-Pd/TiO
MET a été menée pour étudier la morphologie des catalyseurs et les distributions de taille des nanoparticules Au-Pd sur la surface du catalyseur. Les images MET et les histogrammes correspondants des distributions Au-Pd sont présentés sur la figure 3. Il est à noter que plus de 100 nanoparticules ont été mesurées pour calculer la taille moyenne des particules. Comme le montre la figure 3a, le phénomène d'agglomération des porteurs observé sur le catalyseur ATA et la distribution de taille des nanoparticules Au-Pd pourraient être décrits en utilisant une distribution lognormale, avec une taille moyenne d'environ 4,6 nm. Pendant ce temps, il a été trouvé que la brookite TiO2 présentait une forme de tige et la taille moyenne des nanoparticules Au-Pd sur l'ATB était plus petite que la taille des nanoparticules sur l'ATA. Ce résultat était cohérent avec le rapport de Dai [11]. Pour le catalyseur ATR, il a obtenu la dispersion la plus uniforme de nanoparticules Au-Pd sur la surface du catalyseur, et la plus petite taille de particule moyenne (4,1 nm) a été obtenue. Les résultats MET ont indiqué que la taille moyenne des particules et la distribution granulométrique sont fortement liées aux propriétés et aux formes du support de catalyseur.
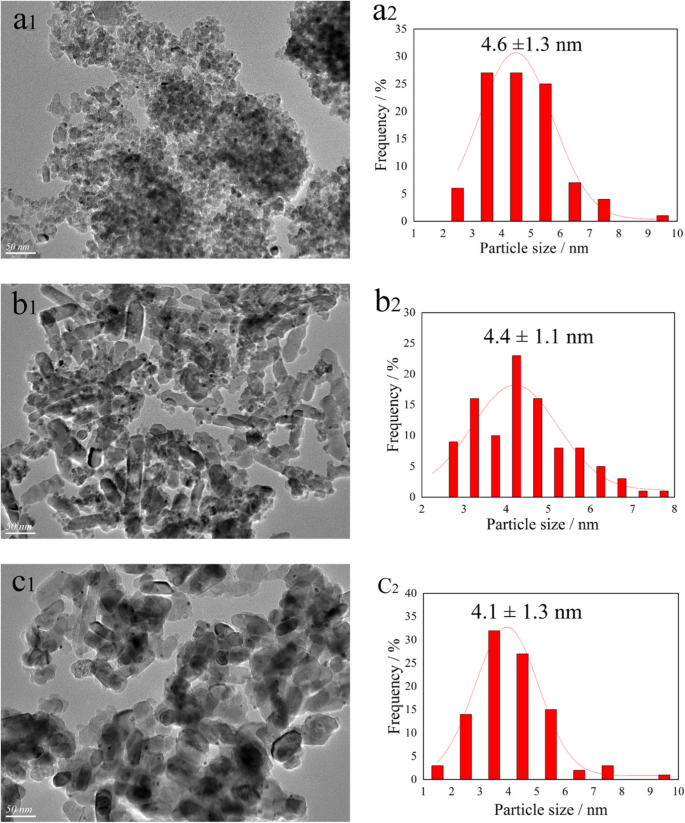
Images MET et histogrammes de distribution granulométrique Au-Pd de l'ATA (a 1 , a 2 ), ATB (b 1 , b 2 ) et ATR (c 1 , c 2 ) catalyseurs
Mesure de l'activité catalytique
Nanoparticules Au-Pd supportées sur différentes formes de TiO2 ont été étudiées pour l'oxydation de l'alcool benzylique, avec 0,3 µMPa d'oxygène pur à 120 °C dans des conditions sans solvant. Les résultats correspondants sont montrés sur la figure 4. Comme on peut le voir sur la figure, la conversion de l'alcool benzylique sur le catalyseur ATR a atteint environ 65,11 % après 3 h de réaction. Cependant, seulement 60,01 % et 51,75 % de conversions d'alcool benzylique ont pu être obtenues sur les catalyseurs ATB et ATA dans les mêmes conditions. En outre, il a été constaté que la conversion de l'alcool benzylique pouvait être organisée dans l'ordre suivant tout au long de la période d'enquête :ATR> ATB> ATA. D'après les résultats de la caractérisation XPS, nous pouvons constater que le Oα et Pd 2+ les ratios présentaient également des tendances similaires, ce qui indiquait que le Oα et Pd 2+ Les ratios jouent un rôle clé dans la détermination des performances catalytiques. De plus, le résultat MET a suggéré que la plus petite taille de particule Au-Pd a été obtenue sur l'ATR, ce qui est également utile pour promouvoir l'activité catalytique. Comme nous le savons tous, les principaux produits de la réaction d'oxydation de l'alcool benzylique sont le benzaldéhyde et le toluène, et les sous-produits restants comprennent le benzène, l'acide benzoïque et le benzoate de benzyle. Tous ces produits ont été détectés au cours de nos expériences et le cas typique est répertorié dans le tableau 3, ce qui est cohérent avec les littératures publiées sur l'oxydation de l'alcool benzylique sur des catalyseurs immobilisés Au-Pd [21, 22]. Pendant ce temps, il a pu être découvert que le catalyseur ATR présentait une sélectivité plus élevée pour le toluène et une sélectivité inférieure pour le benzaldéhyde par rapport aux catalyseurs ATA et ATB pendant tout le processus de réaction (Fig. 5).
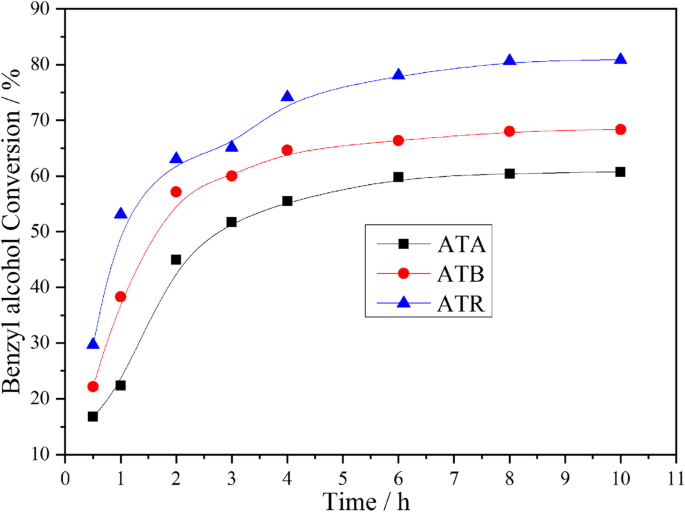
Conversion de l'alcool benzylique en fonction du temps atteint sur l'ATA, l'ATB et l'ATR
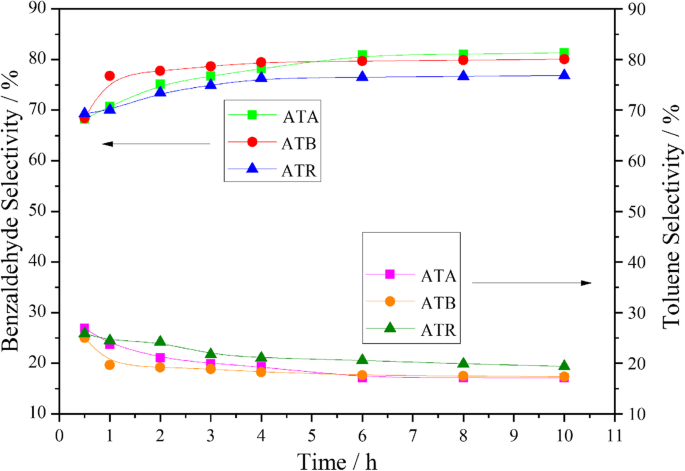
Sélectivités en benzaldéhyde et toluène en fonction du temps obtenues sur l'ATA, l'ATB et l'ATR
Pour étudier plus avant la stabilité de l'Au-Pd/TiO2 catalyseurs dans l'oxydation de l'alcool benzylique, les performances catalytiques des catalyseurs ATA, ATB et ATR ont été étudiées avec des usages répétés. Les résultats correspondants sont fournis sur la figure 6. Après chaque évaluation d'activité, le catalyseur a été séparé de la solution de mélange par centrifugation, puis lavé à l'acétone et chauffé à 80 °C pendant 16 h. Il a été constaté que les échantillons ATA et ATB présentaient une stabilité catalytique supérieure à celle de l'échantillon ATR. La conversion de l'alcool benzylique dans les 1er, 2e et 3e recyclage était respectivement de 51,28 %, 51,06 % et 51,49 % pour le catalyseur ATA et de 59,78 %, 59,54 %, 58,76 % pour l'échantillon ATB. Cependant, la conversion de l'alcool benzylique sur l'échantillon ATR présentait une baisse significative après chaque cycle; l'activité catalytique a diminué de 65,11 % initiaux à 59,22 % finaux, ce qui pourrait être dû à un empoisonnement au Pd. Le Pd a été empoisonné lorsque le catalyseur a été saturé avec les produits au cours de la réaction. Il est largement rapporté que le catalyseur à base de Pd se désactive facilement en raison du problème de désorption des produits aldéhydes sur la surface du catalyseur [22,23,24,25]. Dans notre cas, l'ATR s'est avéré contenir la concentration la plus élevée de Pd (0,65 % atomique) sur la surface du catalyseur d'après les mesures XPS.
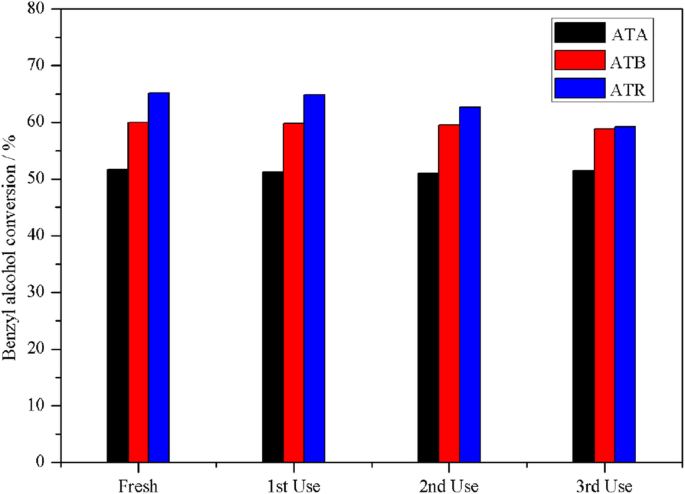
La réutilisation des catalyseurs ATA, ATB et ATR dans l'oxydation de l'alcool benzylique sans solvant
Conclusion
En conclusion, des nanoparticules Au-Pd avec un rapport molaire de 1:1 ont été déposées sur les différentes formes de TiO2 par la méthode de dépôt-précipitation. L'oxydation de l'alcool benzylique a été choisie comme réaction de sonde pour étudier les activités catalytiques en l'absence de solvants. Sur la base des résultats de la caractérisation et de l'évaluation de l'activité, il a pu être constaté que l'activité catalytique de l'Au-Pd/TiO2 catalyseur était fermement lié au TiO2 former. Les résultats de la caractérisation du XPS et du TEM suggèrent que la surface de l'ATR contient un Oα plus grand et Pd 2+ concentrations ainsi que la plus petite taille des nanoparticules Au-Pd par rapport aux catalyseurs ATB et ATA, qui ont joué un rôle essentiel dans l'obtention de la conversion élevée de l'alcool benzylique. Cependant, le catalyseur ATR présentait une stabilité catalytique inférieure à celle des catalyseurs ATA et ATB, ce qui pourrait être lié à la couverture d'une plus grande quantité de produits aldéhydes à la surface pendant le processus de réaction.
Disponibilité des données et des matériaux
Toutes les données sont entièrement disponibles sans restrictions.
Abréviations
- ATA :
-
Au-Pd/TiO2 -anatase
- ATB :
-
Au-Pd/TiO2 -brookite
- ATR :
-
Au-Pd/TiO2 -rutile
- FID :
-
Détecteur à ionisation de flamme
- GC :
-
Chromatographie en phase gazeuse
- ICP-AES :
-
Spectrométrie d'émission atomique à plasma à couplage inductif
- À déterminer :
-
Dihydroxyde de bis (lactate d'ammonium) de titane
- TEM :
-
Microscope électronique à transmission
- TiO2 -A :
-
TiO2 -anatase
- TiO2 -B :
-
TiO2 -brookite
- TiO2 -R :
-
TiO2 -rutile
- XPS :
-
Spectroscopie photoélectronique aux rayons X
- XRD :
-
Diffraction des rayons X sur poudre
Nanomatériaux
- Vers les nanofluides TiO2—Partie 1 :Préparation et propriétés
- Route d'électrofilage en une étape des nanofibres Rutile TiO2 modifiées par SrTiO3 et ses propriétés photocatalytiques
- Activité de préparation et d'hydrogénation catalytique améliorée des nanoparticules de Sb/Palygorskite (PAL)
- Vers les nanofluides TiO2 – Partie 2 :Applications et défis
- Effet de la distribution de nanoparticules d'or dans le TiO2 sur les caractéristiques optiques et électriques des cellules solaires à colorant
- Comparaison des électrodes métalliques à motifs de type nanotrou et de type nanopilier incorporées dans des cellules solaires organiques
- Propriétés structurelles et optiques dans le proche infrarouge du TiO2 dopé au Cr pour les pigments froids colorés
- Matrices de nanotubes TiO2 :fabriquées à l'aide d'un modèle Soft-Hard et de la dépendance de la taille des grains des performances d'émission de champ
- Comparaison du rodage et du rodage



