Nanoparticules pour le traitement du cancer :progrès actuels et défis
Résumé
Le cancer est l'une des principales causes de décès et de morbidité avec une physiopathologie complexe. Les thérapies anticancéreuses traditionnelles comprennent la chimiothérapie, la radiothérapie, la thérapie ciblée et l'immunothérapie. Cependant, des limitations telles que le manque de spécificité, la cytotoxicité et la multirésistance aux médicaments constituent un défi de taille pour un traitement anticancéreux favorable. L'avènement de la nanotechnologie a révolutionné le domaine du diagnostic et du traitement du cancer. Les nanoparticules (1 à 100 nm) peuvent être utilisées pour traiter le cancer en raison de leurs avantages spécifiques tels que la biocompatibilité, la toxicité réduite, une meilleure stabilité, une perméabilité et un effet de rétention améliorés et un ciblage précis. Les nanoparticules sont classées en plusieurs catégories principales. Le système d'administration de médicament à nanoparticules est particulier et utilise des caractéristiques de tumeur et d'environnement tumoral. Les nanoparticules résolvent non seulement les limites du traitement conventionnel du cancer, mais surmontent également la multirésistance aux médicaments. De plus, à mesure que de nouveaux mécanismes de résistance multidrogue sont découverts et étudiés, les nanoparticules sont étudiées plus vigoureusement. Diverses implications thérapeutiques des nanoformulations ont créé de toutes nouvelles perspectives pour le traitement du cancer. Cependant, la plupart des recherches se limitent à des études in vivo et in vitro, et le nombre de nanomédicaments approuvés n'a pas beaucoup augmenté au fil des ans. Cette revue traite de nombreux types de nanoparticules, de mécanismes de ciblage et de nanothérapies approuvées pour leurs implications oncologiques dans le traitement du cancer. En outre, nous résumons également la perspective actuelle, les avantages et les défis de la traduction clinique.
Introduction
Le cancer est un terme générique désignant un ensemble de maladies caractérisées par une division cellulaire aléatoire incontrôlée et un caractère invasif. Depuis plusieurs années, des efforts considérables ont été consacrés à la détection de divers facteurs de risque de cancer. Pour certains cancers, l'étiologie a été associée de manière influente à des facteurs environnementaux spécifiques (facteurs acquis) tels que les rayonnements et la pollution. Cependant, un mode de vie malsain comme une alimentation mal équilibrée, la consommation de tabac, le tabagisme, le stress et le manque d'activité physique ont un impact important sur la détermination du risque de cancer [1, 2]. Bien que ces facteurs externes aient été reconnus comme des causes majeures de cancer, l'implication des mutations des proto-oncogènes, des modèles d'expression des gènes suppresseurs de tumeurs et des gènes impliqués dans la réparation de l'ADN a été difficile à estimer. Seuls 5 à 10 % des cas de cancer sont liés à la génétique héréditaire [3]. L'âge est un autre facteur de risque crucial de cancer et de nombreux types de cancer.
Le cancer est l'un des problèmes de santé publique les plus importants dans le monde et la deuxième cause de décès. Selon l'American Cancer Society, le nombre de nouveaux cas devrait être de 1,9 million d'ici la fin de l'année 2021 [4]. Les approches thérapeutiques conventionnelles utilisées dans le traitement du cancer comprennent la chirurgie, la chimiothérapie, la radiothérapie, la thérapie ciblée, l'immunothérapie et l'hormonothérapie [5, 6]. Bien que la chimiothérapie et la radiothérapie possèdent des capacités de cytostase et de cytotoxicité [7], ces approches sont souvent associées à des effets secondaires aigus et à un risque élevé de récidive. Les effets secondaires les plus courants qui sont induits comprennent les neuropathies, la suppression de la moelle osseuse, les troubles gastro-intestinaux et cutanés, la perte de cheveux et la fatigue. En outre, il existe quelques effets secondaires spécifiques au médicament, tels que la cardiotoxicité et la toxicité pulmonaire induites par les anthracyclines et la bléomycine [8] (Fig. 1).
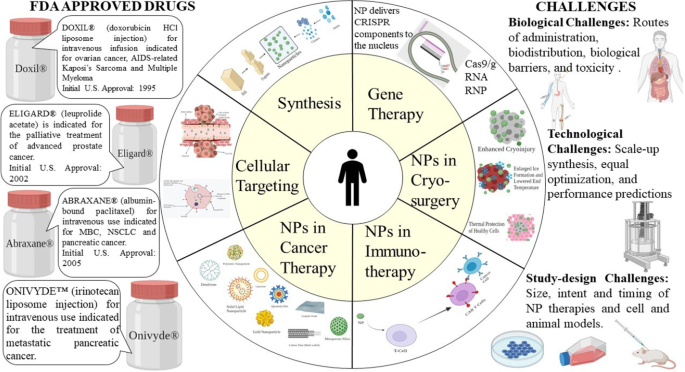
Nanoparticules pour le traitement du cancer
L'avènement de la thérapie ciblée a fait croître la thérapie de précision [9]. Cependant, il existe encore de nombreux effets indésirables inévitables, tels que la multirésistance aux médicaments, limitant l'efficacité thérapeutique [8]. Les agents immunothérapeutiques ont donné des résultats prometteurs non seulement en traitant le cancer primitif, mais en prévenant les métastases à distance et en réduisant le taux de récidive [10]. Néanmoins, la maladie auto-immune est un effet secondaire majeur de l'immunothérapie. De plus, des études et des éléments de preuve suggèrent que l'immunothérapie est moins efficace contre les tumeurs solides que le lymphome [11]. Ces cancers créent une matrice extracellulaire (MEC) inhabituelle qui est assez difficile à infiltrer pour les cellules immunitaires [12]. Ces nouvelles thérapies ciblées et immunothérapies interfèrent avec les voies de signalisation qui sont vitales dans les comportements malins et les fonctions homéostatiques normales de l'épiderme et du derme et provoquent des événements indésirables dermatologiques (dAE) [13].
Compte tenu de tous ces détails, la demande pour l'avancement de nouvelles stratégies pour rechercher un traitement précis du cancer a pris de l'ampleur ces dernières années. Des efforts récents ont été faits pour remédier aux limites des approches thérapeutiques existantes utilisant des nanoparticules. Les systèmes d'administration de médicaments à base de nanoparticules ont reflété les avantages dans le traitement et la gestion du cancer en démontrant une bonne pharmacocinétique, un ciblage précis, des effets secondaires réduits et une résistance aux médicaments [14, 15].
Dans la foulée des progrès de la nanotechnologie, un certain nombre de médicaments nanothérapeutiques ont été commercialisés et sont largement commercialisés, et bien d'autres sont entrés au stade clinique depuis 2010. Les médicaments nanothérapeutiques ont fait des progrès dans le domaine des systèmes d'administration de médicaments et de la multithérapie antitumorale. résistance (MDR) en offrant une chance pour la thérapie combinée de médicaments et l'inhibition des mécanismes de résistance aux médicaments [16]. L'effort de pionnier a été fait pour appliquer la nanotechnologie en médecine à l'ETH Zurich dans les années 1960 [17]. Cette combinaison s'est avérée être une meilleure fusion dans le développement de divers dispositifs de diagnostic et de meilleures thérapies. Cette revue se concentre principalement sur les principes de base de l'application de la nanothérapie, les perspectives des défis actuels et décrit le chemin de la recherche future.
Nanoparticules
Les nanoparticules (NP) sont techniquement définies comme des particules d'une dimension inférieure à 100 nm avec des propriétés uniques généralement introuvables dans des échantillons en vrac du même matériau [18]. Selon la forme globale de la nanoparticule, celles-ci peuvent être classées en 0D, 1D, 2D ou 3D [19]. La composition de base des nanoparticules est assez complexe, comprenant la couche de surface, la couche d'enveloppe et le noyau, qui est fondamentalement la partie centrale du NP et est généralement appelé le NP lui-même [20]. En raison de leurs caractéristiques exceptionnelles telles qu'une surface élevée :rapport de volume, dissemblance, taille inférieure au micron et système de ciblage amélioré, ces matériaux ont acquis beaucoup d'importance dans des domaines multidisciplinaires.
On constate que les NP ont une pénétration profonde des tissus pour augmenter l'effet de perméabilité et de rétention (EPR) amélioré. De plus, les caractéristiques de surface ont un impact sur la biodisponibilité et la demi-vie en traversant efficacement la fenestration épithéliale [21]. Par exemple, les NP recouvertes de polyéthylène glycol (PEG), un polymère hydrophile, diminuent l'opsonisation et contournent la clairance du système immunitaire [22]. De plus, il est possible d'optimiser la vitesse de libération des médicaments ou de la fraction active en manipulant les caractéristiques des polymères des particules. Dans l'ensemble, les propriétés distinctes des NP régulent leur effet thérapeutique dans la gestion et le traitement du cancer.
Synthèse des NP
Les NP sont de différentes formes, tailles et structures. Pour y parvenir, de nombreuses méthodes de synthèse sont adoptées. Ces méthodes peuvent être en grande partie classées en deux groupes principaux :1) approche ascendante et 2) approche descendante. Ces approches peuvent être classées en différentes sous-classes en fonction des conditions de réaction et du fonctionnement (Fig. 2).
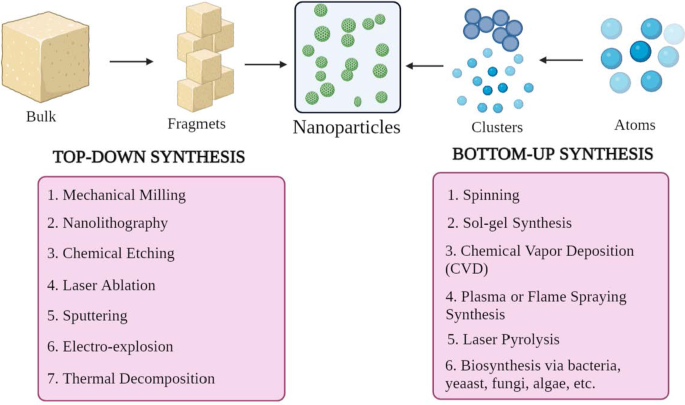
Classification de la synthèse NP a de haut en bas et b approches ascendantes
Approche ascendante
Cette méthode implique la construction de matériaux des atomes aux clusters jusqu'aux NP, c'est-à-dire la construction à partir de substances plus simples, d'où la méthode constructive [23]. Certaines méthodes couramment utilisées sont le filage, la synthèse solgel, le dépôt chimique en phase vapeur (CVD), la synthèse par pulvérisation au plasma ou à la flamme, la pyrolyse laser et la biosynthèse.
Approche descendante
Elle est également connue sous le nom de méthode destructrice, qui réduit la matière ou la substance en vrac pour synthétiser les NP. Une molécule plus grosse est décomposée ou décomposée en unités plus petites qui sont converties en NP [24]. Il comprend des techniques telles que le fraisage mécanique, la nanolithographie, la gravure chimique, l'ablation au laser, la pulvérisation cathodique, l'électro-explosion et la décomposition thermique.
Remarquablement, les paramètres morphologiques tels que la taille, la forme et la charge des NP peuvent être modifiés en changeant les conditions de réaction et d'autres paramètres de synthèse [25]. En outre, le mécanisme de croissance détermine également les propriétés chimiques des NP. Par conséquent, comprendre le mécanisme de croissance est essentiel pour synthétiser les NP requises.
Mécanismes de ciblage cellulaire
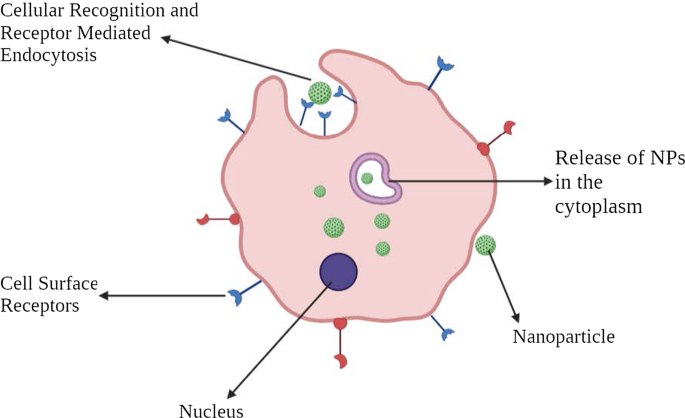
Pour une thérapie efficace contre le cancer, il est essentiel de développer ou de concevoir un médicament ou un système d'administration de gènes ayant une excellente capacité à cibler les cellules tumorales en épargnant les cellules saines normales. Il améliore l'efficacité thérapeutique, protégeant ainsi les cellules normales de l'effet de la cytotoxicité. Cela peut être réalisé par la livraison bien organisée de NP dans le microenvironnement tumoral (TME), ciblant indirectement les cellules cancéreuses. Ces nanoformulations doivent franchir de nombreuses barrières physiologiques et biologiques. Ces barrières sont des systèmes complexes de plusieurs couches (épithélium, endothélium et membranes cellulaires) et de composants (barrières mécaniques et physico-chimiques et barrières enzymatiques). Ces faits imposent des spécifications en ce qui concerne la taille, la biocompatibilité et la chimie de surface des NP pour empêcher un ciblage non spécifique. Cependant, la simple internalisation cytosolique d'une molécule de médicament NP ne signifie pas qu'elle atteint sa cible subcellulaire. Une ingénierie et une optimisation spécifiques sont obligatoires pour permettre le ciblage cellulaire ou nucléaire.
Plusieurs études ont été menées jusqu'à présent et plusieurs autres sont en cours pour découvrir la conception de ciblage de médicaments à base de NP. Ces nanotransporteurs devraient généralement posséder certaines caractéristiques fondamentales telles que 1) la capacité de rester stable dans le système vasculaire (sang) jusqu'à ce qu'ils atteignent leur cible, TME, 2) d'échapper à la clairance du système réticulo-endothélial (RES), 3) d'échapper au système des phagocytes mononucléaires ( MPS), 4) s'accumulent dans le TME via la vascularisation tumorale, 5) pénètrent à haute pression dans le liquide tumoral et 6) atteignent la cible et n'interagissent qu'avec les cellules tumorales [26]. Les aspects vitaux tels que la fonctionnalisation de la surface, les propriétés physico-chimiques et les caractéristiques physiopathologiques régulent le processus de ciblage des médicaments NP.
En règle générale, les NP considérées comme aptes au traitement du cancer ont un diamètre compris entre 10 et 100 nm. Afin de comprendre le processus d'interaction et de diaphonie entre les porteurs de NP et les cellules cancéreuses et la biologie tumorale, il est important d'aborder les mécanismes de ciblage. Les mécanismes de ciblage peuvent être globalement classés en deux groupes, le ciblage passif et le ciblage actif.
Ciblage passif
L'observation d'une accumulation préférentielle de quelques macromolécules dans les cellules cancéreuses a été trouvée à la fin des années 1980. La première macromolécule à s'accumuler dans la tumeur était la poly(styrène-acide co-maléique)-néocarzinostatine (SMANCS) par Matsuura et Maeda [27]. Sur d'autres études, cette distribution préférentielle a été attribuée à l'apparition de fenestrations trouvées dans les vaisseaux sanguins tumoraux endommagés et au mauvais drainage lymphatique, dont la fusion est connue sous le nom d'« effet de perméation et de rétention améliorés ».
Dans certaines conditions telles que l'hypoxie ou l'inflammation, la couche d'endothélium des vaisseaux sanguins devient plus perméable [28]. Dans des situations d'hypoxie, les cellules tumorales à croissance rapide ont tendance à mettre en action plus de vaisseaux sanguins ou à engloutir les vaisseaux existants pour faire face. Ce processus est connu sous le nom de néovascularisation. Ces nouveaux vaisseaux sanguins présentent des fuites car ils ont de gros pores qui conduisent à une mauvaise sélectivité permanente des vaisseaux sanguins tumoraux par rapport aux vaisseaux sanguins normaux [29, 30]. Ces pores ou fenestrations larges vont de 200 à 2000 nm selon le type de cancer, l'ETM et la localisation [31]. Cette angiogenèse rapide et défectueuse offre très peu de résistance à l'extravasation et permet aux NP de se diffuser à partir de ces vaisseaux sanguins et finalement de s'accumuler dans les cellules cancéreuses.
Dans les tissus normaux, le drainage de l'ECF (liquide extracellulaire) dans les vaisseaux lymphatiques se produit fréquemment à une vitesse d'écoulement moyenne de 0,1 à 2 µm/s, ce qui maintient un drainage et un renouvellement constants [32]. Lorsqu'une tumeur se forme, la fonction lymphatique déraille, ce qui entraîne une absorption minimale de liquide interstitiel [33]. Cette caractéristique contribue à la rétention des NP car elles ne sont pas éliminées et s'accumulent dans l'interstitium tumoral. Ce processus dénote la partie de rétention améliorée de l'effet EPR. Cette caractéristique exceptionnelle ne s'applique pas aux molécules avec un temps de circulation court et est rapidement éliminée des cellules cancéreuses. Par conséquent, pour améliorer de telles situations, l'encapsulation de ces petites molécules dans des transporteurs de médicaments de taille nanométrique est régulièrement effectuée pour améliorer leur pharmacocinétique, fournir une sélectivité tumorale et réduire les effets secondaires [34].
Au-delà de l'effet EPR, TME est une caractéristique vitale dans le ciblage passif. L'une des caractéristiques métaboliques importantes des cellules tumorales à prolifération rapide est la glycolyse. C'est la principale source d'énergie pour la division cellulaire [35] et rend le milieu environnant acide. Ce pH abaissé du TME peut être exploité pour utiliser des NP sensibles au pH qui libèrent des médicaments à faible pH [36].
Ce type de ciblage tumoral est qualifié de « passif ». Le ciblage passif repose principalement sur différentes biologies tumorales (vascularité, fuite) et caractéristiques des porteurs (taille et temps de circulation). Ce type de ciblage tumoral ne possède pas de ligand spécifique pour certains types de cellules tumorales. L'effet EPR dépend grandement de la biologie tumorale fondamentale, telle que 1) le degré ou l'étendue de l'angiogenèse et de la lymphangiogenèse, 2) l'étendue ou le degré de l'invasion tumorale périvasculaire et 3) la pression intratumorale. Ces facteurs, combinés aux caractéristiques physico-chimiques des NP, déterminent l'efficacité du système d'administration de médicaments NP (Fig. 3).
Ciblage cellulaire passif
Exemples de ciblage passif
Les taxanes sont l'un des groupes de médicaments les plus efficaces utilisés dans le traitement du cancer. Le paclitaxel a montré une grande puissance contre un large éventail de cancers. Le cancer du sein, le cancer du poumon (à petites cellules et non à petites cellules) et le cancer de l'ovaire sont les histologies les plus traitées avec les taxanes. L'US-FDA, en 2005, a approuvé Abraxane® (paclitaxel lié à l'albumine, Abraxis Bio-Sciences), qui est utilisé pour le cancer du sein avancé ou métastatique (CMB).
Abraxane® est un médicament anti-microtubules qui stabilise les microtubules en empêchant la dépolymérisation. Il se produit lorsque le médicament encourage l'assemblage des microtubules à partir des dimères de tubuline. Cette stabilité gagnée entrave la réorganisation des microtubules, ce qui est très important pendant l'interphase et les fonctions cellulaires mitotiques. Au cours du cycle cellulaire et de la mitose, le paclitaxel, un taxane bien utilisé, déclenche un réseau de microtubules inhabituel ainsi que plusieurs asters, respectivement. Abraxane® seul ou associé à un autre agent cytotoxique tel que la gemcitabine diminue le stroma pancréatique dans des modèles murins de xénogreffe de cancer du pancréas [37].
Genexol PM® est une nanoformulation innovante de paclitaxel et de formulation micellaire polymère lyophilisée stérile sans CrEL. Selon les essais, Genexol PM® s'est avéré avoir une dose maximale tolérée (DMT) trois fois plus élevée chez la souris nude. En outre, la biodistribution présentait des niveaux deux à trois fois plus élevés dans différents tissus tels que le foie, la rate, les reins et les poumons et plus particulièrement dans les cellules cancéreuses. Il a été approuvé en Corée du Sud pour traiter le MBC. Il fait encore l'objet d'une étude clinique de phase II aux États-Unis pour traiter le cancer du pancréas [38].
DaunoXome® (daunorubicine liposomale; Gilead Science/Diatos) est un médicament anticancéreux qui réduit la croissance des cellules tumorales. La substance active est la daunorubicine. Il s'agit d'une formulation unique de daunorubicine (sous forme de liposomes) utilisée pour traiter le sarcome de Kaposi, une forme de cancer qui affecte la peau, les poumons et les intestins. L'US-FDA a approuvé cela en 1996 [39].
Bien que la néovascularisation et l'angiogenèse influencent la diffusion des NP, elles conduisent à une plus grande pression interstitielle, ce qui inhibe l'accumulation des NP. De plus, en raison d'un apport sanguin hétérogène, la croissance des cellules tumorales est irrégulière, c'est-à-dire que les cellules proches des vaisseaux sanguins se divisent plus rapidement que celles qui sont éloignées du vaisseau sanguin ou profondément dans la zone hypoxique ou nécrotique formant le noyau à l'intérieur. la tumeur. Cette fuite irrégulière, qui provoque une pression interstitielle élevée, entrave l'administration et l'accumulation du médicament et ralentit le processus de néovascularisation [34]. Cependant, il est possible de contrôler l'effet EPR, soit mécaniquement, soit chimiquement. Ceux-ci incluent l'oxyde nitrique, le peroxynitrate, la bradykinine, le VPF (facteur de perméabilité vasculaire), les ultrasons, les radiations, l'hyperthermie, etc. Cependant, il existe certaines limitations et contre-indications.
Ciblage actif
Le ciblage actif dépend de ligands ou de molécules spécifiques, comme la transferrine et le folate, qui se fixent sur des molécules ou des récepteurs spécifiquement exprimés ou surexprimés sur les cellules cibles (organes, tissus, cellules ou domaines subcellulaires malades) [40]. Ce type de ciblage est appelé ciblage à médiation par un ligand [41]. Ici, les NP qui possèdent un ligand avec des fonctions spécifiques telles que la rétention et l'absorption doivent être à proximité de la cible afin qu'il y ait une plus grande affinité. Cette stratégie améliore les changements de NP se liant à la cellule cancéreuse, améliorant ainsi la pénétration du médicament. La principale indication de la même chose a été observée en 1980 avec des anticorps greffés à la surface des liposomes [34], suivis par d'autres types divers de ligands comme des peptides, des aptamères. Par conséquent, la méthode principale vise à augmenter la diaphonie entre les NP et la cible sans fluctuer la biodistribution totale [42]. Le mécanisme vital du ciblage actif ou du ciblage médié par un ligand est l'identification du ligand par les récepteurs substrats cibles. Les ligands illustratifs peuvent inclure des protéines, des peptides, des anticorps, des acides nucléiques, des sucres, de petites molécules comme des vitamines, etc. [43]. Les récepteurs les plus couramment étudiés sont le récepteur de la transferrine, le récepteur du folate, les glycoprotéines et le récepteur du facteur de croissance épidermique (EGFR). L'interaction ligand-cible déclenche le repliement de la membrane et l'internalisation des NP via l'endocytose médiée par les récepteurs. Il existe divers mécanismes par lesquels le ciblage actif a lieu. La majorité du ciblage tumoral est effectuée par le ciblage des cellules tumorales en général par les NP. Ce processus améliore la pénétration cellulaire. Comme indiqué précédemment, la transferrine est l'un des récepteurs largement étudiés. C'est un type de glycoprotéine sérique qui aide à transporter le fer dans les cellules. Ces récepteurs sont surexprimés dans la plupart des cellules tumorales, en particulier les tumeurs solides, et sont exprimés à des niveaux inférieurs dans les cellules saines. Par conséquent, nous pouvons modifier les NP avec des ligands associés qui ciblent spécifiquement la transferrine [44]. Par exemple, les cellules de carcinome de l'ovaire A2780 surexpriment la transferrine. Cette caractéristique est utilisée par les NP de PEG-phosphatidyl-éthanolamine (Tf-Mpeg-pe) modifiées par la transferrine qui ciblent spécifiquement ces cellules [45]. Une autre méthode alternative consiste à cibler les cellules adjacentes aux cellules cancéreuses, telles que les cellules endothéliales angiogéniques. Ces cellules sont également en contact étroit avec les vaisseaux sanguins tumoraux. Cette stratégie permet de créer une hypoxie et une nécrose en réduisant l'apport sanguin aux cellules cancéreuses. Il a été découvert que les tissus tumoraux sont plus acides que les tissus normaux. Ceci a été largement expliqué par l'effet Warburg [46]. Cela explique le passage du métabolisme des cellules cancéreuses à la glycolyse, formant de l'acide lactique. Lorsque l'acide lactique s'accumule, la cellule meurt. Pour faire face à cette situation, les cellules commencent à surexprimer les pompes à protons qui pompent l'excès d'acide lactique dans l'environnement extracellulaire, le rendant plus acide. Par conséquent, un système d'administration de médicament sensible au pH à base de liposomes a été étudié.
La nature multivalente des NP améliore la diaphonie des NP recouvertes de ligand avec les cellules cancéreuses cibles. La conception de ces NP est complexe car l'architecture des NP et la chimie ligand-cible influencent l'efficacité de l'ensemble de la méthode. D'autres facteurs tels que la voie d'administration, les propriétés physico-chimiques telles que la densité de ligand [47] et la taille des NP [8] contribuent au succès du système (Fig. 4).
Représentation graphique du ciblage cellulaire actif
Exemples de ciblage actif
L'EGFR, membre de la famille ErbB des récepteurs de la tyrosine kinase (TK), est surexprimé dans divers types de cancer, en particulier avec l'histologie des cellules squameuses. Les NP d'or avec des nanoparticules anti-EGFR-PEG-AuNP et anti-IgG-PEG-Au peuvent être utilisées pour cibler le SCC humain [48].
Herceptin® est un médicament thérapeutique qui cible le récepteur humain EGF-2 (HER2) qui est surexprimé à la surface des cellules du cancer du sein. La doxorubicine liposomale pégylée ciblant HER2 a été développée pour réduire la cardiotoxicité, un effet secondaire connu des anthracyclines [49].
La surface de l'endothélium tumoral exprime une glycoprotéine connue sous le nom de molécule d'adhésion cellulaire vasculaire-1 (VCAM-1) qui est impliquée dans le processus d'angiogenèse. Une étude a mis en évidence des NP qui ciblent VCAM-1 dans le modèle de cancer du sein, indiquant son rôle potentiel [50].
L'acide folique, également connu sous le nom de vitamine B9, est essentiel dans la synthèse des nucléotides. L'acide folique est internalisé par le récepteur du folate qui est exprimé sur les cellules. Cependant, les cellules tumorales surexpriment FR-α (isoforme alpha du récepteur du folate), tandis que FR-β est surexprimée dans les cellules cancéreuses liquides [51]. Le ciblage des récepteurs du folate par les NP est actuellement destiné à des traitements spécifiques contre le cancer [52, 53].
Les nanoparticules dans le traitement du cancer
Les NP largement utilisées dans les systèmes d'administration de médicaments comprennent les NP organiques, les NP inorganiques et les NP hybrides (Fig. 5).
Différents types de nanomatériaux utilisés en cancérothérapie
Nanoparticules organiques
Nanoparticules polymères
Les nanoparticules polymères (PNP) sont bien définies comme des « macromolécules colloïdales » avec une architecture structurelle spécifique formée par différents monomères [54]. Le médicament est soit piégé, soit attaché à l'extérieur des NP, créant une nanosphère ou une nanocapsule pour obtenir une libération régulée du médicament dans la cible [55]. Initialement, les PNP étaient constitués de polymères non biodégradables tels que le polyacrylamide, le polyméthacrylate de méthyle (PMMA) et le polystyrène [56]. Cependant, l'accumulation de ces derniers a conduit à une toxicité en raison de la difficulté à les éliminer du système. Des polymères biodégradables tels que l'acide polylactique, les poly(acides aminés), le chitosane, l'alginate et l'albumine sont maintenant utilisés et sont connus pour réduire la toxicité et améliorer la libération de médicaments et la biocompatibilité [57]. Des recherches éprouvées l'ont montré en enrobant les PNP de polysorbates et en utilisant l'effet tensioactif des polysorbates. Le revêtement extérieur améliore les interactions des NP avec la membrane des cellules endothéliales de la barrière hémato-encéphalique (BHE) [58].
Une étude a montré que des nanocapsules chargées d'indométacine impliquaient une diminution substantielle de la taille de la tumeur et une amélioration de la survie dans un modèle de gliome de xénogreffe chez le rat [59]. Il s'agit d'un domaine en pleine croissance avec plus de dix NP polymères contenant des médicaments anticancéreux en cours de développement clinique. Quelques exemples incluent le paclitaxel poliglumex (Xyotax), le PEG-camptothécine (Prothecan), le dextrane-camptothécine modifié (DE 310), le copolymère HPMA-DACH-platinate (AP5346), le copolymère HPMA-platinate (AP 5280), le copolymère HPMA-paclitaxel ( PNU166945) et le copolymère HPMA-doxorubicine galactosamine (PK2) [60].
Dendrimères
Les dendrimères sont des macromolécules polymères sphériques avec une architecture hyperramifiée définie. Les structures très ramifiées sont le trait caractéristique des dendrimères. Typiquement, la synthèse des dendrimères est initiée en faisant réagir un noyau d'ammoniac avec de l'acide acrylique. Cette réaction entraîne la formation d'une molécule « tri-acide » qui réagit en outre avec l'éthylènediamine pour donner la « triamine », un produit GO. Ce produit réagit en outre avec l'acide acrylique pour donner naissance à de l'hexa-acide, qui produit en outre un produit « hexa-amine » (génération 1) et ainsi de suite [61]. En règle générale, la taille des dendrimères varie de 1 à 10 nm. Cependant, la taille peut atteindre jusqu'à 15 nm [62]. Compte tenu de leur structure spécifique comme le poids moléculaire défini, les branches ajustables, la biodisponibilité et la charge, ceux-ci sont utilisés pour cibler les acides nucléiques. Certains dendrimères largement utilisés sont la polyamidoamine (PAMAM), le PEG (poly(éthylèneglycol)), le PPI (polypropylénimine) et la TEA (triéthanolamine) [63].
Un dendrimère PAMAM a été initialement conçu pour réaliser la gestion MDR. Les dendrimères PAMAM assemblés à l'ADN ont été largement décrits. Par rapport aux animaux traités par chimiothérapie à agent unique, les dendrimères synthétisés ont significativement retardé la croissance des xénogreffes de cancer épithélial [64].
mAb Nanoparticles
Les anticorps monoclonaux sont largement utilisés dans le traitement du cancer pour leurs capacités de ciblage particulières [65]. Ces mAb sont maintenant combinés avec des NP pour former des conjugués anticorps-médicament (ADC). Ceux-ci se sont avérés hautement spécifiques et convaincants que les médicaments cytotoxiques ou les AcM seuls. Par exemple, une NP anticorps-médicament constituée d'un noyau de paclitaxel et d'une surface modifiée avec du trastuzumab a présenté une meilleure efficacité antitumorale et une toxicité plus faible que le paclitaxel ou le trastuzumab en monothérapie seuls dans le contrôle des cellules épithéliales mammaires HER2 positives [66].
Vésicules extracellulaires
Les vésicules extracellulaires (VE) sont des vésicules phospholipidiques à double couche dont la taille varie de 50 à 1 000 nm n [67]. Les véhicules électriques sont continuellement sécrétés par différents types de cellules et varient en origine, en taille et en composition. Les véhicules électriques sont divisés en trois classes : 1) les exosomes, 2) les microvésicules et 3) les corps apoptotiques [68]. Les NP associées aux exosomes sont largement utilisées car elles contiennent des lipides et des molécules très similaires aux cellules d'origine. De plus, ils échappent à la surveillance immunitaire et s'internalisent très rapidement au sein des cellules cancéreuses. Ils agissent comme des véhicules naturels en administrant des médicaments cytotoxiques et d'autres médicaments antitumoraux aux sites cibles. Les exosomes chargés de doxorubicine (exoDOX) en sont le meilleur exemple. exoDOX est utilisé pour traiter le cancer du sein et a montré d'excellents résultats par rapport au traitement conservateur avec la doxorubicine en améliorant la cytotoxicité et en évitant la cardiotoxicité [69]. Les NP d'exosomes ont des caractéristiques de biocompatibilité intrinsèque, une stabilité chimique avancée et des communications intracellulaires par rapport aux NP synthétiques. Néanmoins, des inconvénients tels que le manque de conditions standard pour l'isolement et la purification des exosomes sont cruciaux et doivent être résolus [70, 71].
Liposomes
Ce sont des vésicules sphériques comprenant des phospholipides qui peuvent être soit uni-lamellaires, soit multi-lamellaires pour encapsuler des molécules médicamenteuses [72]. Les liposomes sont uniques en ce qu'ils présentent des caractéristiques telles qu'une faible toxicité intrinsèque, une faible immunogénicité et une inertie biologique [73]. Les liposomes sont le premier médicament à l'échelle nanométrique qui a été approuvé en 1965 [74]. Une structure de liposome typique est composée d'un «noyau hydrophile» et d'une «bicouche phospholipidique hydrophobe». Cette architecture unique leur permet de piéger à la fois des médicaments hydrophiles et hydrophobes pour protéger efficacement le médicament piégé de la dégradation de l'environnement en circulation [75].
Les liposomes fournissent une excellente plate-forme pour l'administration de médicaments tels que la doxorubicine, le paclitaxel et l'acide nucléique en démontrant une efficacité anti-tumorale plus élevée et une biodisponibilité améliorée [76]. Doxil® et Myocet® sont des formulations approuvées à base de liposomes de daunorubicine utilisées pour traiter le MBC [77, 78]. Cependant, en raison de lacunes telles qu'une efficacité d'encapsulation réduite, une élimination rapide par MP, une adsorption cellulaire et une courte durée de conservation, l'application de NP à base de liposomes est limitée.
Nanoparticules lipidiques solides (SLN)
Ce sont des nanosupports colloïdaux (1 à 100 nm) constitués d'une monocouche de phospholipides, d'un émulsifiant et d'eau [79]. Ceux-ci sont connus sous le nom de nanomatériaux de dimension zéro. Le composant lipidique peut être des triglycérides, des acides gras, des cires, des stéroïdes et des lipides pégylés [80]. Unlike conventional liposomes, SLNs have a “micelle-like structure” within which the drug is entrapped in a non-aqueous core. Examples include mitoxantrone-loaded SLN, which has shown reduced toxicity and enhanced bioavailability [81]. The incorporation of doxorubicin and idarubicin by SLN in “P388/ADR leukemia cells” and the “murine leukemia mouse model” has shown positive results [82].
Nanoemulsions
Nanoemulsions are colloidal NPs with heterogeneous mixtures of an oil droplet in aqueous media ranging from 10–1000 nm [83]. Three representative types of nanoemulsions can be made in:1) oil-in-water system, 2) water-in-oil system, and 3) bi-continuous nanoemulsions. Membrane-modified nanoemulsions have been extensively studied. For instance, nanoemulsions loaded with spirulina and paclitaxel showed an improved anti-tumor effect by regulating immunity through TLR4/NF-kB signaling pathways [84]. Nanoemulsion consisting of rapamycin, bevacizumab, and temozolomide is known to treat advanced melanoma [85]. Nanoemulsions are different from liposomes and certainly have enhanced characteristics than others, such as optical clarity, stability, and biodegradability [86]. However, there are challenges to clinical applications of these nanoemulsions as these involve high temperature and pressure and instruments such as homogenizers and microfluidizers that are expensive.
Cyclodextrin Nanosponges
Cyclodextrins are usually used as stabilizers to increase the drug loading capacity of NPs [87]. Nanosponges are tiny, mesh-like structures [88]. Β-cyclodextrin nanosponges loaded with paclitaxel have shown sound cytotoxic effects in MCF-7 cell line culture [89]. Similarly, camptothecin has shown improved solubility and stability when formulated with cyclodextrin-based nanosponges [90].
Inorganic Nanoparticles
Carbon Nanoparticles
Carbon NPs as the name suggests are based on the element carbon. They have been widely utilized in medical arenas because of their optical, mechanical, and electronic properties combined with biocompatibility [91]. Due to their inherent hydrophobic nature, carbon NPs can encapsulate drugs through π-π stacking [92]. Carbon NPs are further categorized into graphene, carbon nanotubes, fullerenes, carbon nanohorns, and graphyne. Although all these are carbon-based, they vary in their structure, morphology, and properties.
“Graphene” is 2D crystal with sp2-hybridized carbon sheet that holds extraordinary mechanical, electrochemical, and high drug loading properties. Further, based on composition, properties, and composition, graphene can be divided as follows:1) single-layer graphene, 2) graphene oxide (GO), 3) reduced graphene oxide (rGO), and 4) multi-layer graphene [93]. GO and rGOs are widely used due to their ability to target hypoxia [94] and irregular angiogenesis in TME [95]. Studies have shown that GO-doxorubicin exhibits higher anticancer activities in cellular models of breast cancer [96].
Fullerenes are large carbon-cage molecules composed of carbon allotrope with different conformation types such as sphere, ellipsoid, or tube. They are the most widely studied nanocarriers as they have typical structural, physical, chemical, and electrical properties [97]. These are used in photodynamic therapy as they have triple yield and generate oxygen species due to the presence of extended π-conjugation and the ability to absorb light [98]. PEG-modified fullerenes showed promising photodynamic effects on tumor cells [99].
Carbon nanotubes (CNTs) are cylindrical tubes, most often considered as rolls of graphene, were discovered in the late 1980s. They are classified into two groups:1) single-walled CNTs and 2) multi-walled CNTs. As they are carbon-based, they can bring upon immune response by interacting with immune cells, thereby suppressing the tumor growth. Traditionally, they have been used as DNA delivery vectors and for thermal ablation therapy. For instance, a fluorescent single-walled CNT with mAb encapsulating doxorubicin is used to target colon cancer cells. Such CNTs form a complex which is effectively engulfed by the cancer cells leading to the intracellular release of doxorubicin, whereas the CNTs are retained in the cytoplasm [100].
Quantum Dots
Quantum dots are typically nanometer-scale semiconductors with a broad spectrum of absorption, narrow emission bands, and high photostability, allowing them to be widely used in biological imaging [101]. Based on carbon, these are divided into:1) graphene quantum dots, 2) nanodiamond quantum dots, and 3) carbon quantum dots. Besides biological imaging, quantum dots are being actively investigated in cancer treatment. The most commonly used quantum dots is graphene quantum dots due to their inherent biocompatibility and rapid excretion. For example, quantum dots aptamer—doxorubicin conjugate targets prostate cancer cells [102]. However, the deficiency of optimized process in producing quantum dots is the major obstacle.
Metallic Nanoparticles
Metallic nanoparticles are commonly explored in “biological imaging” and targeted DDS due to their remarkable optical, magnetic, and photothermal properties. Some of the most commonly used metallic NPs are gold NPs, silver NPs, iron-based NPs, and copper NPs. Gold NPs are used as intracellular targeting drug carriers because the size and surface properties are easily controlled [103]. Moreover, their visible light extinction behavior makes it possible to track NP trajectories in the cells. “Anti-HER2 functionalized gold-on-silica nanoshells” have been shown to aim HER2 positive breast cancer cells [104]. Combidex®, an iron oxide NP formulation, is presently in the late-stage clinical testing phase to detect nodal metastases [105]. Feraheme®, a ferumoxytol containing iron oxide NP formulation, is used to treat iron-deficiency anemia. This is also used to treat nodal metastases in prostate and testicular cancer and was approved by FDA in June 2009 [106, 107].
Magnetic Nanoparticles
Magnetic NPs are generally used in MRI imaging, and drug delivery contains metal or metal oxides. These are usually covered with organic substances like polymers and fatty acids to enhance stability and biocompatibility [108]. LHRH-conjugated superparamagnetic iron oxide NPs are effective in targeting and imaging of breast cancer [109]. Moreover, magnetic NPs are used in magnetic hyperthermia for thermal ablation of cancer cells [110, 111]. Some of the magnetic NPs that are in the market or in the clinical trial phase are Feridex® and Resovist® for liver metastasis and colon cancer [112].
Calcium Phosphate Nanoparticles
“Calcium phosphate NPs” is biologically compatible, biodegradable, and do not cause any harsh adverse reactions. Hence, they are used as a delivery agent for insulin, growth factors, antibiotics, and contraceptives [113]. They are also used in the delivery of oligonucleotides and plasmid DNA [114]. Calcium phosphate NPs combined with either viral or non-viral vector has been positively used as delivery vectors in cellular gene transfer. A “liposomal nanolipoplex formulation” of calcium and glycerol has shown decreased toxicity and enhanced transfection features [115, 116].
Silica Nanoparticles
Silica being a significant component of many natural materials was only studied concerning biology recently. Silica NPs are commonly used to deliver genes by functionalizing the NP surface with amino-silicanes [117]. N-(6–aminohexyl)–3–aminopropyl–trimethoxysilane functionalized silica NPs have shown excellent efficiency in the transfection of Cos-1 cells with minimal toxicity and is now commercially available [118]. Mesoporous silica NPs are considered one of the best drug carriers due to their better pharmacokinetic properties. They have been extensively used in immunotherapy. According to a study, colorectal cancer cells have shown successful uptake of camptothecin-loaded mesoporous silica NPs.
Mechanism of NPs in Overcoming Drug Resistance
Drug resistance is one of the chief problems in cancer therapy and management. It prevails across all types of cancer and all possible treatment modalities. Drug resistance is a phenomenon that results when diseases become tolerant to pharmaceutical treatments. Drug resistance can be classified into two types:1) innate and 2) acquired [119]. Innate resistance usually results from pre-existing mutations in the genes that are involved in cell growth or apoptosis. Acquired resistance is defined as the type of resistance that is developed after a particular anti-tumor treatment, which may result from the development of new mutations or from alterations in the TME during treatment. Nanoparticles, due to their extraordinary ability to co-encapsulate multiple therapeutic agents, can also be used to overcome cancer-related drug resistance.
Targeting Efflux Transporters
Efflux transporters are classified under the family of “ATP-binding cassette (ABC) transporters.” These have a significant role in MDR. The primary function of these transporters is to pump out drugs out of the cell and reduce the concentration. “P-glycoprotein (P-gp)” is one such efflux transporter that is overexpressed by drug-resistant cancer cells [120, 121].
Overexpression of P-gp has been linked with inadequate treatment response, especially in breast cancer [122] and ovarian cancer [123]. NPs can be used to tackle efflux pumps. As NPs internalize the cell via “endocytosis” instead of diffusion and release the drug at the “perinuclear site,” which is distant from active efflux pumps, NPs can bypass the efflux pumps [124]. Besides, by modifying the control of drug releases, such as by utilizing low pH levels and redox as triggers, NPs can effectively bypass efflux pumps [125, 126].
Combination therapy is yet another method to overcome MDR. NPs can be loaded with multiple drugs within a single drug carrier [127]. Inhibiting efflux transporter expression instead of just dodging them would be another viable option. This can be achieved by building NPs in such a way that it can entrap both efflux pump inhibitors and chemotherapy agents [128]. A recent study positively reflected upon reversing MDR in breast cancer cells by using NPs that co-deliver COX-2 inhibitors and doxorubicin [129]. Similarly, using silica NP that encapsulates miRNA-495 and doxorubicin has proved effective in overcoming drug resistance in lung cancer cells [130]. Another interesting study found out that using NPs in the tumor neo-vasculature targeting KDR receptors is a more effective anti-tumor function than P-gp inhibitor combination therapy. Yet, another way of overcoming drug resistance is by depleting the source of ATP, which is essential for the functioning of ABC transporters. This can be done by targeting mitochondria which leads to a decrease in ATP production.
Targeting an Apoptotic Pathway
Cancer cells proliferate due to faulty apoptotic machinery and upsurge their survival adding to drug resistance [131]. The faulty apoptotic pathway gets activated by “deregulation of Bcl-2” and “nuclear factor kappa B (NF-κB).” These are the most widely investigated anti-apoptotic proteins and can be potentially used as the target for reversing drug resistance. Using a classic process of co-delivery of “Bcl-2 siRNA and chemotherapeutics” by NPs is a way to overcome MDR [132]. NF-κB inhibitors have been used in combination with “pyrrolidine dithiocarbamate (PDTC)” [133] and curcumin [134]. Besides suppressing anti-apoptotic factors, triggering pro-apoptotic factors is another to fight “apoptotic pathway-mediated drug resistance.” For instance, a combination of ceramide and paclitaxel is a good example [135]. Ceramide restores the expression of a chief tumor suppressor, p53 protein, by regulating alternative pre-mRNA splicing. Delivering ceramide via NPs is an excellent way to correct the p53 missense mutation [136]. Owing to its potential, a combination of ceramide and paclitaxel has shown significant therapeutic efficacy in cancer drug resistance models. Transfecting the p53 gene by cationic SLNs has been reported in lung cancer cases [137]. Similarly, transfecting the p53 gene by PLGA has been carried out in breast cancer cells models that have shown potent induction of apoptosis and inhibition of tumor growth [138].
Some NP-based DDS act by impeding efflux pumps and encouraging apoptosis [139]. A pioneering study conducted to prove both pump- and non-pump-mediated drug resistance used an “amphiphilic cationic NP” entrapping paclitaxel and Bcl-2 converter gene in drug-resistant liver cancer models. NP complex diminished P-gp-induced drug efflux and the apoptosis activation. Similarly, co-delivery of “doxorubicin and resveratrol encapsulated in NPs” has shown noteworthy cellular toxicity on doxorubicin resistance breast cancer cells by downregulating the expression of Bcl-2 and NF-κB, thereby initiating apoptosis as well as through the inhibition of efflux transporter expression [140]. A similar study was done on multi-drug resistant prostate cancer cells by using folic acid-conjugated planetary ball milled NPs encapsulated with resveratrol and docetaxel. This worked by downregulating anti-apoptotic gene expression while inhibiting ABC transporter markers [141].
Targeting Hypoxia
Hypoxia is yet an additional aspect that backs MDR [142]. Due to abnormal blood vessels in the vicinity of the tumor and due to the increasing demand of oxygen by the rapidly growing tumor, some tumor cells are repeatedly in a hypoxic condition. The part of the tumor that is in hypoxic condition often escapes from the chemotherapy drugs. Hypoxia creates an oxygen ramp inside the tumor that intensifies tumor heterogeneity, encouraging a more aggressive phenotype. Moreover, the hypoxia condition has been established to facilitate the overexpression of efflux proteins [143]. The major protein, “hypoxia-inducible factor 1α (HIF-1α)” acts an important role. Hence targeting HIF-1α or silencing HIF-1α gene is a way to overcome drug resistance. NPs containing HIF-1α siRNA can be used to reduce hypoxia-mediated drug resistance [144]. Instead of directly targeting HIF-1α, indirect inhibition of HIF-1α signaling can be used. For example, the “PI3K/Akt/mTOR pathway” is known to control the expression of HIF-1α. Inhibition of this pathway effectively downregulates the expression of HIF-1α, which enhances the sensitivity of MDR cells to cancer treatment [145]. NPs like PLGA-PEG and PEGylated and non-PEGylated liposomes can be used effectively. In addition, “heat shock protein 90 (HSP90)” is needed for transcriptional activity of HIF-1 and inhibition of HSP90, which downregulates the expression of HIF-1α [146]. The HSP90 inhibitor in “17AAG loaded NPs” has dramatically improved MDR in bladder cancer treatment [147].
Nanoparticles and Proteomics
When NPs are subjected to the biological system, they are surrounded by cellular and serum proteins which form a structure known as protein corona (PC) [148]. Based on the degree of interaction of these proteins with the NPs, there are classified into the hard corona and soft corona. “Hard corona” is formed when these proteins have a high binding affinity towards the NPs. “Soft corona” is produced when these proteins are loosely bound to the NPS. It has been established that the most protein forming a PC first will be eventually substituted by proteins with higher affinities. This is known as Vroman effect [149]. Hence developing the technology that can manufacture NPs with desired properties is essential. Several proteomic approaches such as MS, LC–MS, SDS-PAGE, isothermal microcalorimetry (ITC), etc. [150], are being used. PC affects the crosstalk of NP with the biological setting and thereby governs the application and usage of the same in the medical field.
Cancer proteomics studies the number of proteins in cancer cells and serum, which supports hunting proteins and biomarkers that aids in diagnosis, treatment, and prognosis [151]. It also helps in understanding cancer pathogenesis and drug resistance mechanism. Post-translational modifications (PTMs) play an indispensable part in occurrence, recurrence, and metastasis. Besides using chemotherapy and kinase inhibitors, novel agents like siRNA, mRNA, and gene editing are central therapeutics used with NPs.
Nanotechnology for Small Interfering RNA (siRNA) Delivery
siRNAs are small ds RNA molecules (around 21 nucleotides long) that suppress the expression of genes in the target. This process is known as “RNA interference.” A few siRNA-based NPs that are currently under clinical investigations are ALN-TTR01 that is used to target the transthyretin gene to treat transthyretin-mediated amyloidosis, and Atu027, which is a liposomal siRNA that targets protein kinase N3 and TKM-ApoB that knock downs the expression of ApoB [152, 153].
Nanotechnology for Tumor microRNA Profiling and Delivery
MicroRNAs are a class of endogenous “single-stranded non-coding RNA” molecules that control post-transcription gene expression by blocking translation of the target mRNA or repressing protein production by destabilizing mRNA [154]. These are emerging as vital biomarkers that are a significant target for cancer diagnosis, therapy, and treatment. The base priming nature of nucleic acid forms the very foundation for nanotechnology used miRNA profiling techniques. Several profiling techniques use biosensors or surface plasmon resonance imaging techniques in combination with molecular biology enzymatic reactions. Nanotechnology can be used for the delivery of MicroRNAs. For example, biodegradable polycationic prodrugs showed promising results in the regulation of polyamine metabolism [155]. MicroRNA-loaded polycation-hyaluronic acid NPs of single-chain antibody fragments have shown progressive downregulation of “survivin expression” in high metastatic cancer load in the lung of murine B16F10 melanoma.
DNA Nanotechnology for Cancer Therapy
DNA-based nanostructures have been synthesized for DNA sensors to detect nucleic acid, DNA-coated gold NPs for lead sensing by hybridizing Pb-activated DNAzyme to the linking DNA, scaffolds to organize organics, inorganic, and biomolecules into distinct morphology molecular transporters, and drug delivery (Table 1).
Advantages of Nanoparticles in Cancer Therapy
The utilization of nanotechnology in the diagnosis, treatment, and management of cancer has led to a whole new era. NPs, either by active or passive targeting, augment the intracellular concentration of drugs while avoiding toxicity in the healthy tissue. The targeted NPs can be designed and altered as either pH-sensitive or temperature-sensitive to establish and regulate the drug release. The pH-sensitive drug delivery system can deliver drugs within the acidic TME. Similarly, the temperature-sensitive NPs release the drugs in the target site due to changes in temperature brought in by sources like magnetic fields and ultrasound waves. In addition, the “physicochemical characteristics” of NPs, such as shape, size, molecular mass, and surface chemistry, have a significant part in the targeted drug delivery system. Further, NPs can be modified according to the target and used to target a particular moiety.
Conventional chemotherapy and radiation therapy have several disadvantages concerning efficacy and side effects because of uneven dispersal and cytotoxicity. Therefore, cautious dosing is required that effectively kills cancer cells without any significant toxicity. To reach the target site, the drug has to pass several fortifications. Drug metabolism is a very complex process. In physiological conditions, the drug needs to pass TME, RES, BBB, and kidney infiltration. RES or macrophage system is made up of “blood monocytes, macrophages, and other immune cells” [160]. MPS in the liver, spleen, or lungs react with the drugs and activate “macrophages or leukocytes” that rapidly remove the drug. This leads to a short half-life of the drug [161]. To overcome this, NPs with “surface modification,” such as PEG, bypass this mechanism and increase the “drug half-life.” Besides, kidney infiltration is a crucial function in the human body. Proper kidney infiltration thus minimizes the toxicity caused by NPs.
The brain-blood barrier (BBB) is a specialized protection structure offered to protect the CNS from harmful and toxic agents. “Brain capillary endothelial cells” are arranged in the form of a wall that provides essential nutrients to the brain. Since the primary function of BBB is to block toxic agents to reach the brain, currently available chemotherapy agents for brain cancer are highly limited to intraventricular or intracerebral infusions [162]. However, NPs are known to cross BBB. Now, several approaches such as EPR effect, focused ultrasound, peptide-modified endocytosis, and transcytosis are used to deliver NPs. Glutathione PEGylated liposome encapsulated with methotrexate showed improved methotrexate uptake in rats [163]. Au-NPs are often used as they have proven to help transport drugs to induce apoptosis [164].
NPs being carriers also increase the drug stability by preventing the degradation of the encapsulated cargo. Additionally, a large volume of drugs can be encapsulated without any chemical reaction. Dry solid dosage forms are more stable than nanoliquid products [165]. Stabilizers can be used to enhance stability. Yet another way to increase stability is to use porous NPs.
Tumor has unique pathophysiology features such as extensive angiogenesis, flawed vascular architecture and defective lymphatic drainage. The NPs use these features to target tumor tissue. Due to reduced venous return in tumor tissue and meager lymphatic clearance, NPs are effectively retained. This phenomenon is known as EPR. Similarly, by targeting the adjacent tissues, tumor-targeting can be accomplished [166].
NPs can be administered through several routes like oral, nasal, parenteral, intra-ocular etc. NPs have a high surface-to-volume ratio and intracellular uptake. Studies have reported that NPs are more effective than microparticles as drug carriers [167].
Nanoparticles in Immunotherapy
The immune system sets an important part in the establishment and development of cancer cells. The advancement of immunotherapy has revolutionized cancer therapy. It is found that NPs not only help in target delivery of chemotherapy but can also be used in combination with immunotherapy. There are several approaches in immunotherapy aimed at activating the immune system against cancer cells [168] by “immune checkpoint blockade therapy,” “cancer vaccine therapy,” “chimeric antigen receptor (CAR)-T cell therapy,” and “immune system modulator therapy” [169,170,171]. NP-based immunotherapy includes “nanovaccines,” “aAPCs (artificial antigen-presenting cells),” and “immunosuppressed TME targeting.”
Nanovaccines specialize in delivering “tumor-associated antigens” and “adjuvants” to antigen-presenting cells, such as dendritic cells (DCs) [172]. Moreover, these can also be employed as adjuvants to enhance “APC antigen presentation” and promote DC maturation that leads to the stimulation of cytotoxic T cells that have anti-tumor function [173, 174]. Liposomes, PLGA NPs, gold NPs are found to have the ability to deliver TAAs into DCs in the cytoplasm [175]. Mesoporous silica, the most used inorganic NP, has exhibited an adjuvant role, leading to immune response stimulation [176]. Artificial APCs interact with MHC-antigen complexes directly which binds to T cells. They also bind to co-stimulatory molecules that bind to co-stimulatory receptors leading to T cell activation [177]. Targeting the immunosuppressed TME is yet another method of using NPs in immunotherapies. This is done by targeting essential cell types in TME such as “tumor-associated macrophages (TAMs),” regulatory T cells, and “myeloid-derived suppressor cells (MDSCs).”
Besides, the combination of chemoimmunotherapy has been demonstrated to be a capable approach in cancer therapy. For instance, a study has shown that co-loading Nutlin-3a, which is a chemotherapeutic agent and cytokine GM-CSF, in “spermine-modified acetylated dextran (AcDEX) NPs” improved cytotoxic CD8( +) T cells proliferation and activated an immune response [178].
“Programmed cell death protein 1 (PD-1)” and “programmed cell death ligand 1 (PD-L1)” are some of the essential immune checkpoints [179]. Hence immune checkpoint inhibitors are used to target these using NPs. According to a study, conventional immune checkpoint inhibitors of PD-L1/PD-1 displayed inconsistent responses. To enhance the chances and bonding of immune checkpoint inhibitors and immune checkpoints, multivalent poly (amidoamine) dendrimers were used. Usage of these dendrimers not only showed enhanced PD-L1 blockade but also showed improved drug accumulation at the tumor site [180].
Nanoparticles in Cryosurgery
Cryosurgery is an advanced practice of freeze-destroying cancer tissue. Although this is less invasive and causes intraoperative bleeding and postoperative complications, certain drawbacks like inadequate freezing capacity and damage to adjacent cells need to be addressed [181]. The rise of nanotechnology has enabled the use of NPs in cryosurgery.
The primary working of nanocryosurgery is introducing NPs with particular properties into the cancer cells and causing freezing [182]. During this process, ice is formed within the cells, which causes damage to it. This is an important process and can be carried out effectively using NPs. The thermal conductivity property of NPs can be exploited, which significantly freeze the tumor tissue and cause tumor damage [183]. Besides, they cool down rapidly, and it is feasible to regulate the “growth direction” and “direction of the ice ball” (Fig. 6).
Diagrammatic representation of NPs in cryosurgery
When the location of the tumor makes it not feasible for cryosurgery or if other adjacent organs are at risk, there are high chances that the freezing can damage healthy tissue. Recently, phase change materials (PMs) made up of NPs are used to protect the adjacent normal healthy tissue during cryosurgery [184]. For instance, liposome-based microencapsulated phase change NPs have shown incredible results in protecting surrounding healthy tissue [185]. These NPs are deemed to possess large latent heat and low thermal conductivity, making them perfect for cryosurgery.
Significant Challenges in the Clinical Application of Nanoparticles
At present, as nanotechnology has bloomed, the amount of knowledge and research put into nanoparticles has steeply raised. But only a few of them actually make it up to clinical trials. Most of them only halt at in vivo and in vitro stages. Each individual nanoformulation has particular challenges in their clinical translation, but most NPs face similar challenges that can be divided into biological, technological, and study-design related.
Biological challenges include lack of routes of administration, tempering biodistribution, the channel of NPs across the biological barriers, their degradation, and toxicity [186]. NPs are usually injected via intravenous injections directly into the blood, which takes away NPs, making it challenging to stay and interact with the target site. As a result, a high concentration drug is used, which might not provide desired therapeutic effects [187]. However, magnetic NPs can be used to overcome this as many in vivo and in vitro studies have proved the usage of 3D magnetic fields to control the movement of NPs against blood flow. But, the effect of magnetic fields on the human body, crosstalk between magnetic fields, and a large number of NPs has to be researched upon.
Controlling the biological fate of NPs is very hard and needs a lot of focus. Even though NPs are made up of biosafety materials and are modulated accordingly to increase the retention time and half-life, there runs a risk of lung, liver and kidney damage. Some factors that govern toxicity are surface area, particle size and shape, solubility, and agglomeration [188]. NPs have shown greater deposition in the lung with inflammatory, oxidative and cytotoxic effects [189]. Studies reveal that healthy cells often suffer from free radicals generated by NPs [190]. Fabricating NPs with more biocompatible substances like chitosan and materials that disintegrate after near infrared light irradiation may be potential solutions.
Another tricky challenge is avoiding the “mononuclear phagocytic system (MPS).” In biological fluids, NPs adsorb proteins to produce PC, which attacks MPS to uptake NPs. To escape this, NPs have been coated with materials that prevent the formation of the protein corona. However, they have not shown any significant results. Designing NPs that target “macrophages” and using those as new drug vehicles can be pitched to overcome this problem. Currently, preventing macrophage recruitment, depleting and reprograming TAMs, and obstructing “CD47-SIRPα pathways” are commonly used strategies [191].
Technological challenges of NPs include scale-up synthesis, equal optimization, and performance predictions. These are very crucial in safeguarding the clinical success of NPs. Most of the NPs that are used in vivo and in vitro studies are usually produced in minor batches, and scale-up for huge quantities is not constantly feasible given instrumentation and other reasons. The lead clinical candidates that prove to be the best in animal models are not systematically designed optimized. To overcome this, we can use certain methods that can test numerous nanoformulation and by selective iterations selecting a single optimized formulation [192,193,194]. However, such hits shouldn’t be introduced directly in human testing. Predicting nanoparticle efficacy and performance is hard and replicating the in vivo results in human trials is a herculean task. Computational or theoretical modeling along with experimental results can be designed to imitate physiological tissue and surrounding. For instance, organs-on-chips are being actively studied and can improve NP predictions of efficacy and performance.
Study-design challenges like study size, intent, and timing of NP therapies during the therapy impact significantly during clinical studies. Most of the studies revolve around “cell and animal models” that may not provide comprehensible results in human trials. Therefore, the usage of a single model is tough to imitate natural reactions in the human body. In addition, “models of cancer metastasis” should be actively researched as metastasis is one of the significant properties of cancer. Moreover, N = 1 clinical studies will be required if we focus on personalized medicine. This needs to count in many factors such as genetic, environmental, and past medical history. [195, 196]. Another major challenge is that NPs are never used as first-line therapies. Although we have effectively approved nanoformulations, they are usually saved for further treatment if disease progression is found in the clinical trial scenario. Most of the patients have either had progressed on multiple lines of therapies or have gained drug resistance. These situations often skew the clinical trial results and lessen the chance of NP treatment to benefit those who are likely still treatable.
Conclusion and Future Perspective
Nanotechnology has shown a promising new era of cancer treatment by delivering small molecules for cancer detection, diagnosis, and therapy. Cancer therapies based on the exceptional features of NPs are being vastly used in the clinical setting of several cancer types. NP-based DDS is linked with enhanced pharmacokinetics, biocompatibility, tumor targeting, and stability compared to conventional drugs. Moreover, NPs provide an excellent platform for combination therapy which helps in overcoming MDR. With increasing research, several types of NPs, such as polymeric NPs, metallic NPs, and hybrid NPs, have shown improved efficacy of drug delivery. Researchers must be well attentive to the features of the nominated nanoplatforms and the properties of therapeutic agents. However, there are certain limitations like deficiency of in vitro models that precisely replicate in vivo stage, immunotoxicity, the long-term toxicity, and neurotoxicity. Although “nanovaccines” and “artificial APCs” have proved improved efficacy compared to conventional immunotherapy, the clinical efficacy is substandard. The safety and tolerance of these new modalities should to be inspected. Additionally, developing “immunomodulatory factor-loaded NPs” may advance the efficiency of vaccines for immunotherapy.
This is an emerging area, and it is anticipated that with growth in proteomics research on the “mechanism of cancer origin, MDR, occurrence,” more NP-based drugs can be exploited. Compared to the mammoth amount of investigations, only a few NP-based drugs are actually in use, a few others in clinical trials, and most in the exploratory stage. For rational nanotechnology design, more efforts must be reserved in “understanding toxicity, cellular and physiological factors that regulate NP-based drug delivery, EPR, and PC mechanism” in the human body. Based on the evidence cited above, we presuppose that the revolution in clinical translation for NP-based cancer therapy will be attained with nanotechnology and cancer therapy development.
Availability of Data and Materials
Not applicable.
Nanomatériaux
- Les cinq principaux problèmes et défis de la 5G
- Démonstration d'un biocapteur flexible à base de graphène pour la détection sensible et rapide des cellules cancéreuses de l'ovaire
- Nanoparticules d'or multifonctionnelles pour des applications diagnostiques et thérapeutiques améliorées :une revue
- Avancées et défis des nanomatériaux fluorescents pour la synthèse et les applications biomédicales
- Nanoparticules d'albumine chargées de resvératrol avec une circulation sanguine prolongée et une biocompatibilité améliorée pour une thérapie ciblée très efficace contre les tumeurs pancréat…
- Nouveaux nanoparticules Au Nanostars@PEG biocompatibles pour l'imagerie CT in vivo et les propriétés de clairance rénale
- Synthèse et performances in vitro de nanoparticules de fer-platine revêtues de polypyrrole pour la thérapie photothermique et l'imagerie photoacoustique
- Nanoassemblages 5-aminolévulinique-squalène pour la photodétection et le traitement des tumeurs :études in vitro
- Comprendre les avantages et les défis de la fabrication hybride



