Nanoskein de polyaniline :méthode synthétique, caractérisation et détection redox
Résumé
Le nanoskein de polyaniline (PANS), qui contient des nanofibres de polyaniline, a été développé. Le PANS a été formulé via des processus séquentiels d'extraction, de chauffage et de gonflement. Les compositions des PANS ont été analysées à l'aide de la spectroscopie photoélectronique aux rayons X, de la spectroscopie infrarouge à transformée de Fourier, de l'analyse thermogravimétrique et de l'analyse Brunauer-Emmett-Teller, et les résultats indiquent que le PANS est composé uniquement de matériaux organiques. De plus, les PANS ont montré des caractéristiques d'absorbance convertibles en fonction des environnements acides environnants, et en utilisant ces caractéristiques, la possibilité de PANS pour la détection des changements d'état redox environnants est présentée.
Introduction
Les structures inorganiques en forme de fleur ont été utilisées pour diverses applications telles que la catalyse [1, 2], les biocapteurs [3, 4] et les agents théragnostiques [5]. Il existe des stratégies synthétiques pour générer ces structures complexes. La synthèse à l'aide d'un modèle est la première approche, par exemple, le liposome a été utilisé comme modèle souple pour guider la formation de feuilles de Pt dendritiques [6, 7]. La seconde approche est basée sur le phénomène d'attachement orienté de nanoparticules primaires lorsque des surfaces avec des arrangements atomiques similaires se rapprochent les unes des autres. La synthèse de nanoparticules dendritiques de PtRu forme des nanoparticules primaires de PtRu facettées, qui était basée sur ce principe [8]. La troisième approche repose sur l'utilisation d'agents de coiffage ou de tensioactifs spécifiques pour induire une croissance anisotrope de matériaux inorganiques. Les synthèses de multipodes de Pt et Au en présence de poly(vinylpyrrolidone) ou de bromure de cétyltriméthylammonium en sont des exemples [9, 10]. De plus, après la première approche de Ge et al. [2], les structures hybrides organiques-inorganiques en forme de fleur ont été intensivement étudiées. Dans le processus de synthèse des structures hybrides en forme de fleur, les combinaisons de diverses protéines (par exemple, enzymes [11] et ADN [12]) et d'ions métalliques (par exemple, Cu [13], Ca [14, 15] et Mn [16]) ont été utilisés. Ces dernières années, des études ont montré que la synthèse de structures en forme de fleur était basée sur la polyaniline (PAni) en utilisant un dopage acide fort [17] et des nanofibres de polyuréthane [18]. En outre, plusieurs rapports ont fait état de structures en forme de fleur composées de matériaux organiques, tels que des matériaux carbonés dopés à l'azote [19, 20] et du polyacrylonitrile [21].
Dans cette étude, nous rapportons une méthode de formulation de structures organiques en forme de fleur, qui est principalement composée de PAni, et ses propriétés matérielles. PAni, qui est un polymère conducteur représentatif, a été utilisé comme composant organique dans cette étude. PAni est bien connu pour ses propriétés optiques convertibles en raison de ses processus uniques de dopage/dédopage ou d'oxydation/réduction [22]. En utilisant ce phénomène, notre groupe de recherche a rapporté que les nanostructures médiées par PAni peuvent être utilisées comme agents photothermiques [23] et sondes de détection redox [24, 25] pour des applications biomédicales. En particulier, la bande interdite électronique pour PAni peut être contrôlée par des états de dopage/dédopage [26]. La différence entre les états de dopage et de dédopage affecte les changements de spectres optiques de PAni dans le domaine visible [24]. Ces états de dopage et de dédopage du PAni peuvent être ajustés par divers dopants, tels que les acides forts, les acides de Lewis, les métaux de transition et les ions alcalins [23].
Nous avons nommé les particules de PAni en forme de fleur comme PAni nanoskein (PANS) parce que la forme de PANS ressemble à une pelote de fil, composée de nanofibres de PAni. De plus, le PAni tel que synthétisé semble former intrinsèquement une structure moléculaire fibrillaire et linéaire telle que du fil. Le PANS a été synthétisé lorsque nous avons ajouté de l'éther benzylique (BE) à une solution de N-méthyl-2-pyrrolidone (NMP) contenant du PAni, et ce mélange a été soumis à des processus de chauffage et de purification (Fig. 1a). Et puis, les changements des états redox environnants ont été mesurés sur la base du changement de couleur des PANS, où les propriétés optiques ont été converties (Fig. 1b). Cependant, de nombreux rapports publiés précédemment ont détecté du glucose à l'aide de méthodes ratiométriques de fluorescence via divers mécanismes de détection [27,28,29]. À notre connaissance, les recherches les plus récentes pour la détection du glucose à l'aide des propriétés optiques convertibles de PAni étaient déficientes.
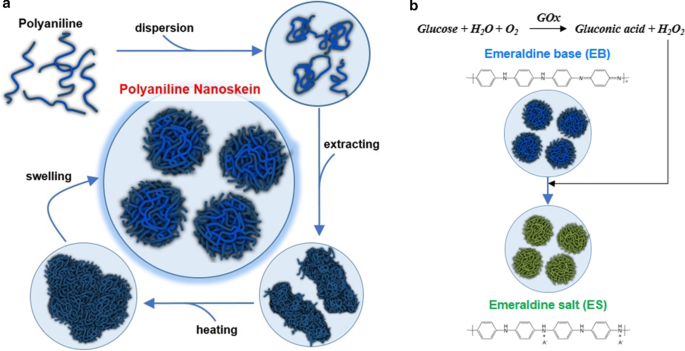
un Le procédé de synthèse de la nanoskein de polyaniline (PANS). b Processus de détection du glucose à l'aide de PANS
Matériaux et méthodes
Matériaux
La polyaniline (PAni) Mw ~ 5000, l'éther benzylique (BE), la glucose oxydase (GOx, d'Aspergillus Niger, 145 200 unités/g) et le D-( +)-glucose ont été achetés auprès de Sigma-Aldrich (St. Louis, MO, ETATS-UNIS). La N-méthyl-2-pyrrolidone (NMP) et l'éthanol (EtOH) ont été achetés auprès de Dae-jung, Corée. La solution saline tamponnée au phosphate (DPBS) de Dulbecco a été achetée à Welgene, Corée, et la solution tampon (pH 4) a été achetée à Samchun, Corée. Tous les autres produits chimiques et réactifs étaient de qualité analytique. De l'eau déminéralisée ultrapure (DW) a été utilisée pour tous les procédés de synthèse.
Synthèse de Polyaniline Nanoskein (PANS)
Le processus de synthèse du produit immaculé était le suivant :du PAni (250 mg) a été dissous dans de la NMP (20 mL), puis du BE (40 mL) a été ajouté. Le mélange a été préchauffé à 200 °C pendant 1 h et chauffé à 300 °C pendant 30 min. Le réactif a été refroidi à température ambiante pendant 3 h. La solution résultante a été lavée avec EtOH et séparé le précipitant par centrifugation à 3000 tr/min pendant 10 min. Ensuite, la solution a été redispersée dans EtOH. Ensuite, la solution dissoute dans EtOH a été dialysée à l'aide d'une membrane de dialyse (MWCO :3 500 Spectra/Por® 6, SPECTRUM® LABORATORIES, Rancho Dominguez, CA, USA) pendant 24 h. Après dialyse, la solution a été centrifugée à 15 000 tr/min pendant 30 min. Le précipitant a été redissous dans 30 mL de DW. La concentration finale de PANS a été calculée à 8,33 mg/mL.
Caractérisation des PANS
La morphologie des PANS a été évaluée par imagerie au microscope électronique à transmission (TEM, JEM-1011, JEOL Ltd, Japon) et au microscope électronique à balayage (SEM, JSM-6701F, JEOL Ltd, Japon). Les spectres de photoélectrons aux rayons X ont été enregistrés en utilisant un système K-alpha (Thermo Fisher Scientific, Waltham, MA, USA). Une analyse des spectres infrarouges à transformée de Fourier (FT-IR Spectrum Two, PerkinElmer, Waltham, MA, USA) a été effectuée pour confirmer les bandes caractéristiques des PANS synthétisés, et la distribution de la taille des PANS a été analysée par une diffusion dynamique de la lumière (ELS-Z , Otsuka electronics, Japon). De plus, la surface et le volume des pores des PANS ont été mesurés par un analyseur Brunauer-Emmett-Teller (Autosorb-iQ 2ST/MP, Quantachrome Instruments, Boyton Beach, FL, USA), et la quantité pondérale de PANS a été analysée avec un appareil thermogravimétrique. analyseur (SDT-Q600, instrument TA, New Castle, DE, USA). De plus, l'absorbance du PANS a été analysée à l'aide d'un spectrophotomètre UV-Vis (Optizen 2120UV, MECASYS Co., Corée).
Détection du glucose à l'aide de PANS
Tout d'abord, la concentration de GOx a été ajustée à 15 mg/mL en utilisant du DPBS, et le glucose a été dilué avec une solution tampon pH 4. Les concentrations de glucose résultantes ont été fixées à 40, 20, 10, 5 et 1 mg/mL, respectivement. Et puis, 1 mL de PANS (1,67 mg/mL) a été mélangé avec 20 L de GOx (15 mg/mL) et 80 L de glucose (40, 20, 10, 5 et 1 mg/mL, respectivement). Les concentrations finales de glucose dans les solutions mélangées ont été calculées comme 2,91, 1,45, 0,73, 0,36 et 0,07 mg/mL, respectivement. L'absorbance des PANS avec GOx et glucose a été analysée à l'aide du spectrophotomètre UV-Vis.
Résultats et discussion
La morphologie du PANS a été confirmée par des images au microscope électronique à transmission (MET) et au microscope électronique à balayage (MEB), comme le montre la figure 2. Le PANS présentait une forme sphérique avec des structures hiérarchiques. Dans le processus de synthèse du PANS, le PAni a d'abord été dissous dans la NMP, puis le BE a été ajouté à la solution de PAni/NMP. En raison de la différence de solubilité pour PAni entre NMP et BE, PAni a été extrait dans le mélange, ce processus a donc été appelé processus « d'extraction ». Après le processus d'extraction, PAni est apparu sous forme fibrillaire, et cette forme peut être générée en raison de la proximité entre les molécules de PAni (la première rangée de la Fig. 2 et voir également le fichier supplémentaire 1 :Fig. S1). Après cela, le mélange a été chauffé séquentiellement à 200 °C pendant une heure et à 300 °C pendant 30 min (processus de « chauffage »). Le NMP a un point d'ébullition à environ 203 °C, donc PAni existait en BE après le processus de chauffage. Après le processus de chauffage, PAni était plus nucléé que dans le processus d'extraction, et la forme des PANS est devenue arrondie. De plus, la surface des PANS a commencé à se plisser, mais de nombreuses particules de PANS se sont agrégées (la deuxième rangée de la Fig. 2 et voir également le fichier supplémentaire 1 :Fig. S1). Par la suite, les PANS ont été lavés et gonflés à l'aide d'éthanol (EtOH) (la troisième rangée de la figure 2 et voir également le fichier supplémentaire 1 :figure S1). Après le processus de gonflement, EtOH serait inséré entre les molécules de PAni, de sorte que la distance intermoléculaire serait également augmentée. En conséquence, PANS existait au niveau des particules individuelles et avait également une structure hiérarchique. Pour confirmer la condition idéale de formulation du PNAS, la concentration de PAni a également été contrôlée (Fichier complémentaire 1 :Fig. S2). Une analyse d'image TEM en fonction de la quantité d'alimentation de PAni à chaque processus synthétique (c. a été formulé de manière beaucoup plus clairsemée. De plus, la structure hiérarchique du PANS a certainement été confirmée via une image SEM inclinée à 90° avec une quantité d'alimentation de PAni à 50 mg/mL (Fichier supplémentaire 1 :Fig. S3). Pour les études détaillées du mécanisme de formulation du PANS, le test de solubilité du PAni a été préférentiellement réalisé (Fichier complémentaire 1 :Fig. S4). Le PAni était connu comme hydrophobe et dissous dans un solvant aprotique polaire miscible à l'eau tel que la NMP [24]. La forme fibrillaire de PAni a été observée lorsque PAni a été dissous dans de la NMP. D'autre part, PAni dans BE et EtOH avait une taille plus agrégée et plus grande que dans NMP; en outre, PAni dans EtOH pourrait interagir de manière clairsemée avec chaque molécule de PAni. Les tests de solubilité du PAni utilisant des mesures de spectres d'absorbance ont également été menés; EtOH a montré la meilleure solubilité parmi l'EtOH, le BE et l'eau déminéralisée (DW). Les molécules nues de PAni se sont à peine dissoutes dans le DW. De plus, des expériences dans d'autres conditions ont été menées en fonction du poids moléculaire (Mw) de PAni (Fichier supplémentaire 1 :Fig. S5). Dans le cas de Mw 5 kDa, les PANS présentaient plus de structures semblables à des écheveaux que d'autres conditions (c'est-à-dire Mw 10 kDa et 50 kDa). Dans d'autres cas, PAni n'a pas nucléé comme Mw 5 kDa, et ce phénomène peut être dû à des différences de solubilité par rapport à la NMP pour PAni. En d'autres termes, lorsque la Mw de PAni est augmentée, PAni a tendance à être insoluble dans la NMP et, par conséquent, PAni n'existerait pas de nanofibres de PAni dans la NMP. En conséquence, il n'existait pas suffisamment de nanofibres de PAni, de sorte que les structures de type écheveau de PANS ne seraient pas non plus formulées. A partir de ces résultats, la formulation du PANS est émise comme suit :(1) le PAni nu ne se dissout pas du tout dans le DW ; (2) PAni a la meilleure solubilité dans la NMP; (3) PAni dans la NMP a été extrait par l'ajout de BE via la différence de solubilité ; (4) la NMP a été vaporisée par un procédé de chauffage à partir d'un mélange PAni/(NMP et BE) ; (5) la solution résultante est lavée par EtOH, et l'EtOH est inséré entre les molécules de PAni; (6) Les particules PANS sont gonflées et bien dispersées dans le DW.

Morphologie des PANS par imagerie au microscope électronique à transmission (TEM, à gauche) et au microscope électronique à balayage (SEM, à droite). Les caractères alphabétiques représentent les processus synthétiques séquentiels des PANS ; (E) :extraction du réactif avec BE, (H) :chauffage séquentiel du réactif à 200 °C et 300 °C, et (S) :gonflement du réactif à l'aide d'EtOH. A noter que (X) :pas de traitement. Les barres d'échelle mesurent 500 nm
Pour étudier les caractéristiques des PANS, tout d'abord, une analyse d'imagerie TEM à haute résolution (HRTEM) a été réalisée (Fig. 3a). PANS avait la morphologie d'une pelote de laine, qui était composée de nombreuses nanofibres PAni. Pour vérifier la structure moléculaire du PANS, une analyse par spectroscopie photoélectronique à rayons X (XPS) pour le PAni nu (bPAni) et le PANS a été réalisée (Fig. 3b et voir également le fichier supplémentaire 1 :Fig. S6). Les spectres de niveau de base C1s peuvent être déconvolués en quatre pics :C=O/C–O à 286,7 eV (1), C=N + /C–Cl à 285,8 eV (2), CN/C=N à 285,0 eV ( 3), et C–C/C–H à 284,4 eV (4), respectivement. La déconvolution des C1 était basée sur les données rapportées précédemment par Golczak et al. [30]. En particulier, les changements de distributions pour (3) et (4) étaient remarquables, et ces résultats signifient que la portion d'azote a été augmentée dans les PANS. Ce phénomène peut être attribué à l'existence de NMP dans les structures de PANS, et cette molécule de NMP affecte les interactions entre les molécules de PAni pour la formulation de PANS. Pour étudier plus avant la structure moléculaire des PANS, les spectres infrarouges à transformée de Fourier (FTIR) pour bPAni et PANS ont également été analysés (Fig. 3c et voir également le fichier supplémentaire 1 :Fig. S7). Les pics à 1290 cm −1 (étirement aromatique C–N), 1490 cm −1 (étirement C=C et C=N de l'anneau benzénoïde) et 1590 cm −1 (étirement C=C et C=N de l'anneau quinoïde) ont été confirmés dans les deux cas pour bPAni et PANS. Les pics spécifiques de PANS à 1670 cm −1 (astérisque sur la Fig. 3c) pourrait être attribué à l'amine tertiaire dans la NMP, et ce pic a également été observé dans le spectre FTIR de la NMP (Fichier supplémentaire 1 :Fig. S7). Les résultats de l'analyse thermogravimétrique (TGA) du bPAni et du PANS révèlent que le PANS était composé non seulement de PAni mais également d'autres molécules (Fig. 3d). La dégradation de bPAni a été observée à environ 350 °C ; cependant, le point de dégradation des PANS a été observé à environ 200 °C, ce qui coïncide avec le point d'ébullition de la NMP. Des résultats XPS aux résultats TGA, la figure 3b–d révèle que le PANS n'était pas seulement composé de PAni pur, mais également de PAni et d'autres composés organiques tels que la NMP. De plus, la surface et le volume des pores des PANS ont été déterminés par l'analyse de Brunauer-Emmett-Teller (BET) (Fig. 3e), et les PANS avaient 9,486 ± 0,728 m 2 /g de surface et 0,044 ± 0,004 cm 3 /g de volume poreux. (c.f. 6,358 ± 0,682 m 2 /g de surface et 0,019 ± 0,001 cm 3 /g de volume poreux pour bPAni, respectivement.) Ces résultats signifient que le PANS est plus poreux avec un rapport surface/volume élevé que le PAni nu. La distribution du diamètre hydrodynamique des PANS présentait 799 ± 85 nm dans une solution aqueuse (Fig. 3f). Ces résultats de la figure 3 montrent que le PANS est uniquement composé de composés organiques (PAni et NMP) avec des structures hiérarchiques.
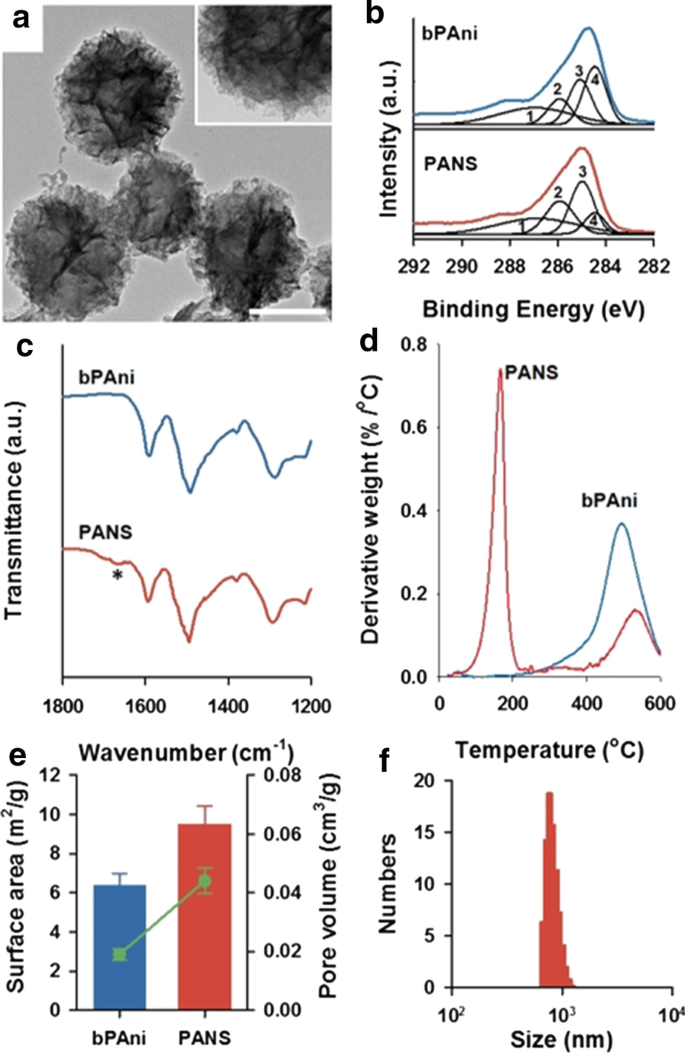
un Images de microscopie électronique à transmission (HRTEM) à haute résolution de PANS. La barre d'échelle est de 100 nm et l'encart est une image à fort grossissement. b Spectres XPS C1s de polyaniline nue (bPAni) (en haut) et PANS (en bas). 1 : C=O/C–O, 2 : C–N + /C=N + , 3 :C–N/C = N, 4 :C–C/C–H. c Spectres FTIR de bPAni (en haut) et PANS (en bas). Un astérisque représente un pic intéressant décrit plus en détail dans le texte. d Analyse thermogravimétrique (TGA) de bPAni (en haut) et PANS (en bas). e Surface (bar) et volume des pores (ligne et dispersion) de bPAni et PANS en utilisant l'analyse Brunauer-Emmett-Teller (BET). f Distribution de la taille des PANS via la méthode de diffusion dynamique de la lumière (DLS)
Pour étudier la possibilité des PANS en tant que sondes optiques convertibles, les changements de couleur des PANS ont été analysés à l'aide de spectres d'absorbance. Les modifications des propriétés d'absorbance des structures PAni, telles que les nanoparticules, les films et les feuilles, sont bien connues pour faire varier ses états de dopage/dédopage. Les états de dopage/dédopage de PAni peuvent être ajustés par divers dopants, tels que les acides forts, les acides de Lewis, les métaux de transition et les ions alcalins [31, 32]. Les PANS présentaient également ces propriétés en fonction des changements des valeurs de pH environnantes (Fig. 4). À des niveaux de pH bas (< pH 2), les PANS sont passés à un état de sel d'émeraude (ES, couleur verte), comme indiqué par la présence de la transition π–π* des anneaux benzénoïdes ainsi que des transitions de bande polaron à environ 480 et 800-900 nm, respectivement [33]. Avec des valeurs de pH croissantes, les pics à 480 et 800-900 nm diminuent progressivement en absorbance, et un fort pic d'absorbance à environ 680 nm est observé. Le pic d'absorbance à 680 nm est attribué à l'excitation de l'orbitale moléculaire occupée la plus élevée de la partie benzénoïde à trois anneaux du PAni à l'orbitale moléculaire inoccupée la plus basse de l'anneau quinoïde localisé et des deux azotes imine environnants dans la base émeraldine (EB) état du PAni [34]. Pour distinguer plus précisément entre les états ES et EB des PANS, le rapport d'absorbance (λ 680 /λ 480 ), a été calculé à des positions de longueur d'onde représentatives des pics aux états EB et ES des PANS, respectivement (Fig. 4c). Lorsque la valeur du pH a diminué de 10 à 4, le rapport d'absorbance s'est maintenu à près de 1,06 et a diminué de façon spectaculaire à près de 0,88 à des valeurs de pH de 4 à 1. Ces résultats indiquent que les changements spectraux de PANS peuvent être utilisés pour évaluer les changements spécifiques de état redox par les changements des environnements environnants.
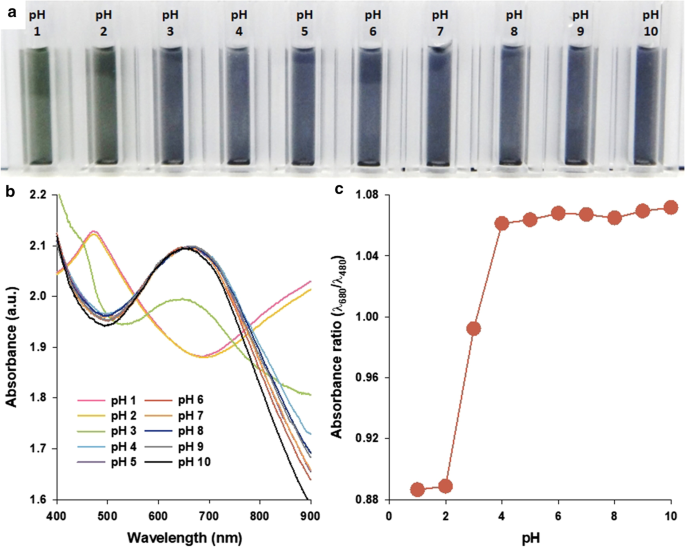
un Une photographie, b spectres d'absorbance, et c rapport d'absorbance pour les longueurs d'onde représentatives pour les états EB (à 680 nm) et ES (à 480 nm) des solutions PANS dans les conditions de pH indiquées
Pour étudier la capacité de détection des PANS pour des changements spécifiques d'état redox à partir des changements d'environnements environnants, le glucose et le GOx ont été sélectionnés comme candidats représentatifs. En augmentant les concentrations de glucose de 0,00 à 2,91 mg/mL, la couleur des solutions PANS est passée du bleu au vert (Fig. 5a). Les spectres d'absorbance des PANS ont également été analysés (Fig. 5b), mais les changements de forme dans les spectres étaient inférieurs à ceux des expériences avec des changements de pH comme le montre la Fig. 4. Ce phénomène peut être expliqué par les équations suivantes :
$${\text{Glucose}} + {\text{H}}_{2} {\text{O}} + {\text{O}}_{2} \mathop{\longrightarrow}\limits^{ {\text{GOx}}}{\text{Gluconic}}\,{\text{acide}} + {\text{H}}_{2} {\text{O}}_{2}$$ ( 1) $${\text{H}}_{2} {\text{O}}_{2} + {\text{PANS}}\,({\text{EB}}) \to 2{\ text{e}}^{ - } + {\text{O}}_{2} + {\text{PANS}}\,({\text{ES}})$$ (2)Dans l'éq. (1), le glucose est oxydé par les GOx, ce qui donne de l'acide gluconique et du peroxyde d'hydrogène. De plus, comme le montre l'éq. (2), le peroxyde d'hydrogène résultant est réduit des PANS dans l'état EB à l'état ES. Cependant, les valeurs du rapport d'absorbance (λ 680 /λ 480 ) ont été formés entre 0,98 et 0,86, et ce résultat indique que PANS existe à l'état intermédié (λ 680 /λ 480 = 0.98) et état ES (λ 680 /λ 480 =0,86) comme le montre la figure 5c. La réaction entre le glucose et le GOx est une réaction d'oxydoréduction représentative, et cette réaction est bien connue pour produire du peroxyde d'hydrogène, ce qui entraîne la formation d'ions hydrogène et d'électrons. Ces résultats indiquent que les PANS peuvent être dopés avec des ions hydrogène et des électrons. En conséquence, la transition π–π* du cycle benzénoïde est observée dans les spectres d'absorbance via la formation d'épaulement à 480 nm. Collectivement, ce résultat indique que les PANS peuvent être utilisés pour détecter des enzymes telles que le glucose. On pense que PANS pourrait également être utilisé pour détecter l'activité d'autres enzymes et pour confirmer l'activité redox dans le système biologique.
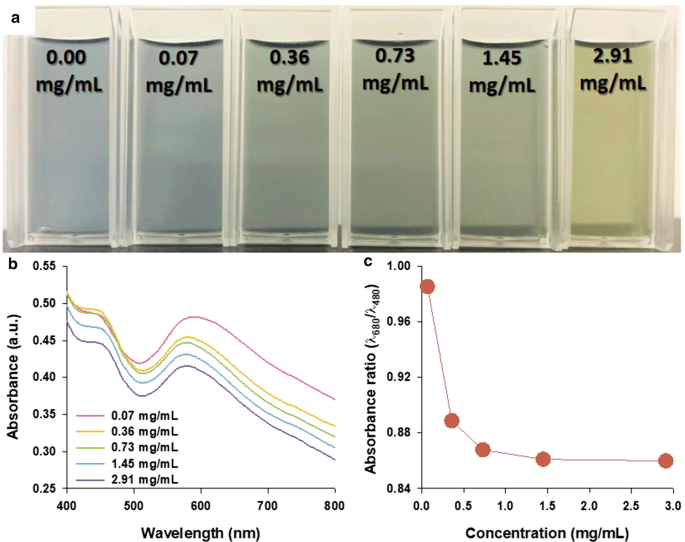
un Une photographie, b spectres d'absorbance, et c rapport d'absorbance pour les longueurs d'onde représentatives pour les états EB (à 680 nm) et ES (à 480 nm) des solutions PANS avec les concentrations de glucose indiquées
Conclusion
En résumé, la formulation de PANS en forme d'écheveau, qui est composé de fibres de PAni, a été réalisée, et le mécanisme de formulation a également été proposé. Le processus de synthèse des PANS contient des processus séquentiels d'extraction, de chauffage et de gonflement. Les compositions des PANS ont été analysées, qui sont composées uniquement de matériaux organiques. De plus, les possibilités des PANS en tant que sondes optiques convertibles pour la détection des changements d'états redox environnants ont été confirmées via le changement des valeurs de pH et la combinaison de glucose et de GOx. La présente étude met en lumière la synthèse d'une nouvelle classe de nanostructures en forme de 3D ainsi que de nanobiocapteurs pour la détection des changements d'état redox environnants.
Disponibilité des données et des matériaux
Toutes les données générées ou analysées au cours de cette étude sont incluses dans cet article publié.
Nanomatériaux
- Méthode et analyse du courant de maillage
- Classe abstraite et méthode C#
- Classe partielle C# et méthode partielle
- Classe et méthode scellées C#
- Fabrication facile de composite polyaniline poreux multi-hiérarchique comme capteur de pression et capteur de gaz à sensibilité réglable
- Conception de matériaux de nanotubes de carbone soignés et composites par caractérisation porosimétrique
- Fabrication et caractérisation d'un nouveau support de catalyseur anodique en nanofibre de carbone composite Tio2 pour pile à combustible au méthanol direct via la méthode d'électrofilage
- Fabrication, caractérisation et activité biologique de systèmes de nano-administration d'avermectine avec différentes tailles de particules
- Progrès récents dans les méthodes de synthèse et les applications des nanostructures d'argent



