Stabilité et variabilité de l'auto-assemblage des protéines de la coquille des microcompartiments bactériens en réponse au changement environnemental
Résumé
Les microcompartiments bactériens (BMC) sont des organites d'auto-assemblage protéiques qui sont répandus dans le royaume procaryote. En segmentant les enzymes et les voies métaboliques clés à l'aide d'une coquille polyédrique, les BMC jouent un rôle essentiel dans l'assimilation du carbone, la pathogenèse et l'écologie microbienne. L'enveloppe BMC est composée de plusieurs homologues de protéines qui s'auto-assemblent pour former l'architecture définie. Il existe un intérêt considérable pour l'ingénierie des BMC pour développer de nouveaux nanobioréacteurs et échafaudages moléculaires. Nous rapportons ici la caractérisation quantitative de la formation et de la dynamique d'auto-assemblage des protéines de la coquille BMC dans diverses conditions de pH et de sel en utilisant la microscopie à force atomique à grande vitesse (HS-AFM). Nous montrons qu'une concentration en sel de 400 mM est susceptible d'entraîner des plaques de coquille monocouche plus grandes formées par des hexamères de coquille, et un taux dynamique plus élevé d'auto-assemblage d'hexamères a été observé à pH neutre. Nous visualisons également la variabilité des protéines shell des assemblages hexamériques aux tableaux de type fibre. Cette étude fait progresser nos connaissances sur la stabilité et la variabilité des auto-assemblages de protéines BMC en réponse aux changements microenvironnementaux, ce qui éclairera la conception et la construction rationnelles de structures BMC synthétiques avec la capacité de remodeler leur auto-assemblage et leur robustesse structurelle. Il offre également une puissante boîte à outils pour évaluer quantitativement l'auto-assemblage et la formation de nanostructures à base de BMC dans les applications biotechnologiques.
Introduction
Les microcompartiments bactériens (BMC) sont des organites protéiques, ressemblant structurellement à des capsides virales, qui divisent le cytoplasme des bactéries [1]. Ils sont répandus parmi les phylums bactériens [2] et permettent aux bactéries de compartimenter des voies métaboliques clés en l'absence d'organites membranaires trouvées chez les eucaryotes [3, 4]. Les BMC sont formées par une enveloppe protéique semi-perméable encapsulant un noyau enzymatique luminal. La coque est composée de trois types de composants protéiques structurels, dont BMC-H (contenant un domaine Pfam00936), BMC-T (contenant deux domaines Pfam00936) et BMC-P (avec un domaine Pfam03319) [5,6,7, 8,9]. Les principaux composants de la coque sont le BMC-H, qui se présente sous la forme d'hexamères avec des surfaces convexes et concaves et tuile les facettes de la coque avec leur côté concave tourné vers l'extérieur [10] (Fig. 1). Le BMC-P forme des pentamères qui sont proposés pour coiffer les sommets de la forme icosaédrique, et le BMC-T forme des pseudohexamères qui sont situés dans les facettes de la coque vraisemblablement responsables de la perméabilité de la coque.
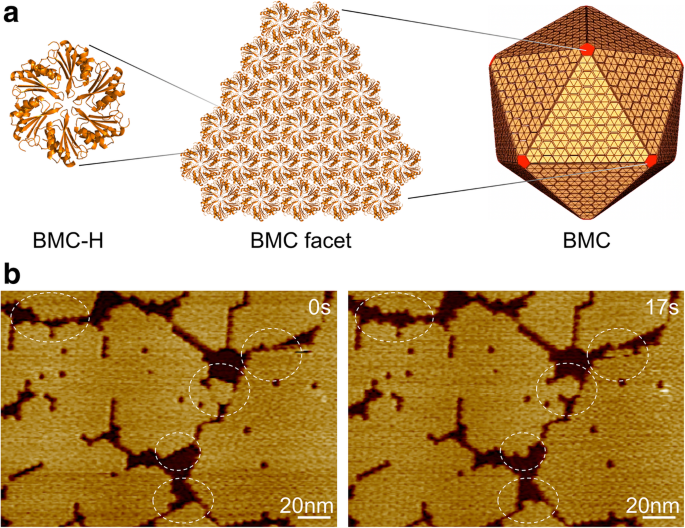
Microcompartiment bactérien, organisation de la coquille et auto-assemblage. un Des centaines de copies d'homologues de la protéine shell BMC s'auto-assemblent pour former un organite protéique icosaédrique. Les protéines BMC-H, en jaune, forment les facettes et les protéines BMC-P, en rouge, occupent les sommets. b Topographes AFM de facettes de coque composées d'hexamères Hoch_5815 BMC-H. Des événements dynamiques (cercles) ont été observés en quelques secondes à l'aide du HS-AFM
Des interactions protéine-protéine spécifiques assurent l'auto-assemblage des protéines BMC pour former des architectures hautement définies pour remplir leur fonctionnalité métabolique. Les interactions latérales entre les protéines de la coquille sont supposées être le facteur majeur pour déterminer les propriétés d'auto-assemblage de la coquille icosaédrique [10]. Il a été observé que les homologues BMC-H peuvent former diverses formes, y compris des feuilles bidimensionnelles [11, 12], des nanotubes [13,14,15,16,17] et des structures de filaments [15, 18,19,20] .
Sur la base des propriétés d'auto-assemblage, de perméabilité sélective et d'encapsulation d'enzymes des organites naturels, les BMC ont été considérés comme un système idéal avec un grand potentiel en bio-ingénierie, y compris la construction bioinspirée de bioréacteurs à l'échelle nanométrique en enfermant des enzymes métaboliques et la génération de nouveaux échafaudages moléculaires avec nouvelles fonctions [21,22,23,24,25,26]. Cependant, certains problèmes clés restent à résoudre dans la bio-ingénierie BMC, par exemple, la stabilité des structures BMC et la manière de manipuler et d'évaluer efficacement l'auto-assemblage et la formation d'agrégats de protéines BMC. Des études sur les structures et l'assemblage de coques BMC et de BMC entiers ont été menées à l'aide de la cristallographie aux rayons X, de la microscopie électronique (EM), de la microscopie à fluorescence et de la diffusion dynamique de la lumière (DSL) [10, 11, 16, 22, 27,28 ,29,30,31]. Récemment, nous avons exploité l'AFM à grande vitesse (HS-AFM) pour effectuer la première visualisation du processus d'auto-assemblage dynamique des protéines BMC-H [12].
Dans ce travail, nous utilisons HS-AFM pour surveiller la dynamique structurelle des patchs BMC-H dans des conditions de pH et ioniques variables, ce qui donne un aperçu de la modulation de l'assemblage de la protéine shell BMC et offre un outil puissant pour l'évaluation quantitative, à la résolution moléculaire , sur la stabilité et la variabilité de l'auto-assemblage de la protéine shell BMC.
Méthodes
Préparation de l'échantillon
La protéine BMC-H purifiée (Hoch_5815) de Haliangium ocraceum a été gracieusement fourni par le Dr Kerfeld (Lawrence Berkeley National Laboratory). Pour l'échange tampon, des échantillons de stock à ~ 80 mg mL −1 en tampon Tris (Tris-HCl 50 mM, pH 7.8, KCl 100 mM, MgCl 10 mM2 ) ont été dilués à 0,5 mg mL −1 en utilisant le tampon souhaité avant l'imagerie AFM (Fichier supplémentaire 1 :Figure S1). Le tampon de contrôle est du Tris-HCl 50 mM (pH 7,8) et du MgCl 10 mM2 .
Microscopie à force atomique
Les tampons souhaités ont été utilisés pour l'absorption des échantillons sur le mica et l'imagerie AFM. Après 5 min d'absorption sur le mica, les Hoch_5815 ont été rincés avec le tampon souhaité pour éliminer les protéines immobilisées, puis imagés à l'aide de l'AFM (Fichier supplémentaire 1 :Figure S1). Les images HS-AFM ont été capturées à 30 ou 40 Hz en solution en mode AC à l'aide d'un AFM JPK NanoWizard ULTRA speed équipé d'un scanner ULTRA Speed 2,8 μm et de sondes Ultra-Short Cantilever USC-0,3 MHz (NanoWorld). Des forces de charge minimales d'environ 100 picoNewton ont été appliquées pendant l'imagerie AFM pour réduire la perturbation de l'assemblage des protéines [12, 32, 33, 34, 35, 36].
Traitement et analyse d'images
L'analyse des images a été initialement effectuée à l'aide de JPK SPM Data Processing (JPK). L'analyse d'image HS-AFM a été effectuée à l'aide d'une macro personnalisée sur Image SXM (http://www.ImageSXM.org.uk), comme décrit précédemment [12]. Pour analyser les tailles des patchs Hoch_5815, des images de 512 × 512 pixels capturées à une fréquence de balayage de 30 Hz ont été aplaties pour supprimer toute inclinaison XY et seuil Z, suivies d'une conversion binaire pour afficher la protéine par rapport à la non-protéine. L'analyse des particules a été utilisée pour calculer la surface des protéines dans ces images binaires. Les patchs ont été définis comme des objets séparés par> 3 pixels (~ 2 nm), afin d'identifier les patchs individuels par rapport aux patchs adjacents. Les premiers tests ont montré que si un plus grand nombre de pixels est défini, les patchs adjacents pourraient être comptés comme un seul patch continu, tandis qu'en utilisant un nombre de pixels plus petit, les écarts entre les hexamères individuels dans les patchs pourraient être considérés à tort comme la limite entre les patchs. Pour analyser la dynamique des protéines, des séries d'images de 256 × 256 pixels capturées à une vitesse de balayage de 40 Hz ont été analysées, donnant une résolution temporelle d'environ 6,4 s par image. Les images binaires ont été soustraites de l'image précédente de la série pour montrer les différentes images AFM. L'analyse des particules des images de différence a été utilisée pour compter la surface des protéines assemblées et désassemblées. L'équation utilisée pour calculer le taux dynamique est présentée comme suit :
$$ \mathrm{Taux}\ \mathrm{de}\ \mathrm{dynamique}\ \mathrm{événements}\ (R)=\frac{\mathrm{Nombre}\ \mathrm{de}\ \mathrm{hexamers} \ \mathrm{ajouté}\ \mathrm{ou}\ \mathrm{supprimé}\ \mathrm{in}\ \mathrm{a}\ \mathrm{s}\mathrm{eries}\ \mathrm{of}\ \mathrm {frame}\mathrm{s}\kern0.5em (N)}{\mathrm{Total}\ \mathrm{surface}\ \mathrm{zone}\ \mathrm{of}\ \mathrm{protéine}\ \mathrm{ in}\ \mathrm{frame}\kern0.5em (A)\times \mathrm{time}\kern0.5em (T)}, $$où N représente la somme des pixels blancs et noirs dans une image de différence seuillée divisée par le nombre de pixels correspondant à un seul hexamère à cette échelle (Fichier supplémentaire 1 :Figure S3, Figure S5). Les données sont présentées sous la forme d'une moyenne ± déviation standard (SD). L'analyse statistique a été effectuée à l'aide d'une ANOVA multivariée ou d'une ANOVA à deux facteurs comme spécifié.
Résultats
Nous avons utilisé les protéines BMC-H (Hoch_5815) d'une myxobactérie Haliangium ocraceum , qui ont été exprimés dans Escherichia coli et caractérisés comme des hexamères avec une symétrie sextuple [12]. Les hexamères Hoch_5815 pourraient s'auto-assembler pour former des feuilles monocouches à la deuxième échelle de temps, qui représentent les composants structurels de base de l'architecture BMC icosaédrique (Fig. 1a). L'imagerie HS-AFM nous permet de visualiser l'assemblage dynamique et la flexibilité organisationnelle des fragments de feuille (Fig. 1b) et d'estimer quantitativement la taille du patch et le taux dynamique des protéines BMC-H à l'aide de l'analyse d'imagerie développée (voir la section « Méthodes »).
Réponse à la variation du pH
Nous avons mesuré les changements de taille de patch comme indication de la capacité globale de Hoch_5815 à s'auto-assembler. La taille du patch augmente avec l'augmentation du pH de 3 à 10 (Fig. 2a ; Fichier supplémentaire 1 :Figure S2, Tableau S1), suggérant qu'un pH élevé est plus favorable à l'auto-assemblage des protéines Hoch_5815 que des conditions de pH bas. Ceci est quelque peu distinct des comportements d'assemblage des protéines RmmH, qui se sont révélées insolubles à pH 6, forment des réseaux ordonnés de nanotubes à pH 8 et étaient sujettes au désassemblage à pH 10 [13]. De plus, nous avons observé un degré élevé de variabilité structurelle des auto-assemblages HOCH_5815 (comme indiqué par un grand SD sur la figure 2a, fichier 1 supplémentaire :figure S2).
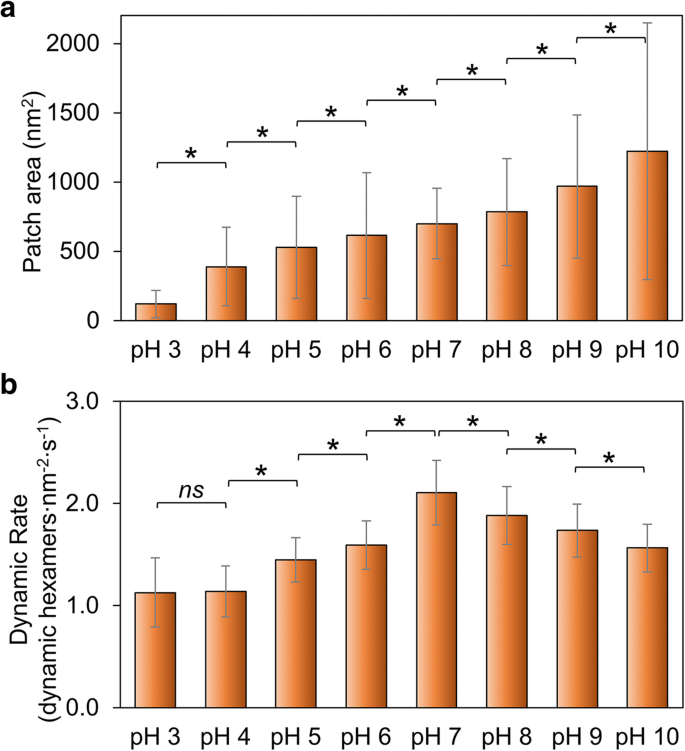
Effets du pH environnemental sur l'auto-assemblage de Hoch_5815. un Les surfaces moyennes des parcelles individuelles de Hoch_5815 déterminées par l'AFM (n = 50) (Fichier supplémentaire 1 :Figure S2). b Les taux moyens d'événements dynamiques déterminés par HS-AFM (n = 50). *p < 0,05, ns non significatif (ANOVA multivariée)
L'imagerie AFM sur l'auto-assemblage des protéines Hoch_5815 dans des feuillets de coquille a révélé que la formation de feuillets de coquille est attribuée à une combinaison d'assemblage et de désassemblage d'hexamères [12]. Nous avons également examiné les taux de dynamique d'auto-assemblage de Hoch_5815 et d'événements dynamiques sous différents pH (Fichier supplémentaire 1 :Tableau S2) pour explorer la stabilité des interactions protéine-protéine Hoch_5815. Le taux de dynamique d'auto-assemblage est le plus élevé à pH 7 et diminue à la fois dans des conditions acides et alcalines (Fig. 2b ; Fichier supplémentaire 1 :Figure S3). En particulier, il décline rapidement en conditions acides, notamment de pH 7 à pH 6 et apparaît relativement constant entre pH 4 et pH 3, comme le montre la Fig. 2b.
Il est probable que le pH ait un grand impact sur les propriétés électrostatiques des résidus d'acides aminés situés à l'interface hexamère-hexamère. La dynamique réduite et une plus petite taille des plaques de coquille observées dans des conditions acides illustrent que Hoch_5815 a une capacité d'auto-assemblage réduite. La dynamique réduite et une plus grande taille des plaques de coquille observées dans des conditions alcalines suggèrent des interactions hexamère-hexamère stables, tandis que la dynamique accrue des hexamères Hoch_5815 implique des interactions hexamère-hexamère flexibles dans des conditions de pH neutre.
Réponse à la variation des concentrations de sel
Nous avons également vérifié si la concentration en sel du tampon a des impacts sur l'assemblage de Hoch_5815. À de faibles concentrations (100-200 mM) de MgCl2 , CaCl2 , et KCl, les protéines Hoch_5815 forment des patchs relativement plus petits que ceux assemblés à des concentrations plus élevées (300-500 mM) (Fig. 3a ; Fichier supplémentaire 1 :Figure S4). À 500 mM, nous avons observé des feuilles Hoch_5815 double ou multicouche (Fichier supplémentaire 1 :Figure S4). Ces observations sont cohérentes avec la découverte précédente selon laquelle une force ionique plus élevée pourrait faciliter la formation de cristaux 2D plus étendus et bien ordonnés par CcmK, les protéines de la coque des carboxysomes pour l'assimilation du carbone [37]. Cependant, les nanotubes hautement ordonnés formés par RmmH ont été désassemblés lorsque la concentration de NaCl est passée de 50 à 500 mM [13], indiquant les mécanismes potentiellement différents qui interviennent dans la formation de feuilles plates et de formes tubulaires par les hexamères de coque.
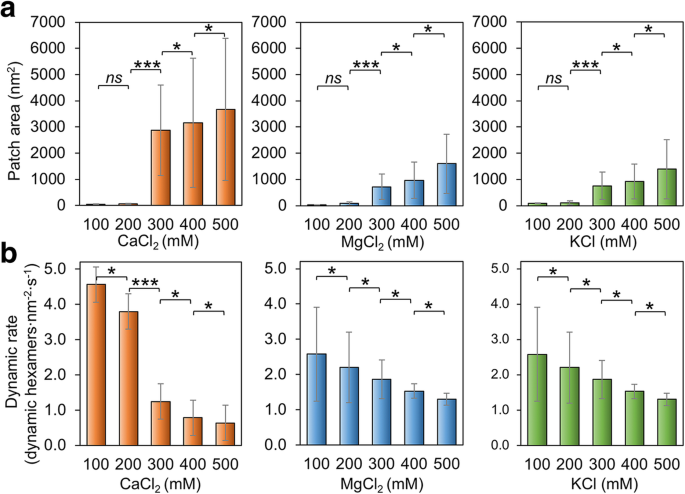
Effets de la concentration en sel sur l'auto-assemblage de Hoch_5815. un Les zones de patch moyennes mesurées par AFM dans une plage de 100 à 500 mM CaCl2 , MgCl2 , et KCl (n = 50). L'augmentation de la concentration en sel a entraîné une augmentation de la taille des patchs. Des changements significatifs dans la zone de patch ont été observés entre 200 et 300 mM (***p < 0.001, *p < 0,05, ns non significatif, ANOVA à deux facteurs). b Les taux moyens d'événements dynamiques déterminés à partir de séries d'images AFM à grande vitesse dans une plage de 100 à 500 mM CaCl2 , MgCl2 , et KCl (n = 50). Chaque changement de 100 mM de la concentration en sel a entraîné un changement significatif dans le taux d'événements dynamiques (***p < 0.001, *p < 0,05, ns non significatif, ANOVA bidirectionnelle)
De plus, les variations de l'auto-assemblage Hoch_5815 causées par les changements de MgCl2 et les concentrations de KCl sont relativement similaires. En revanche, le changement de taille de patch est plus prononcé (jusqu'à une augmentation de 3000 fois) lorsque le CaCl2 la concentration est augmentée de 200 à 300 mM (Fig. 3a), suggérant la plus grande sensibilité de l'auto-assemblage Hoch_5815 au CaCl2 qu'à MgCl2 ou KCl.
La vitesse dynamique de l'auto-assemblage Hoch_5815 est également affectée par les modifications de la concentration en sel du tampon. L'augmentation de MgCl2 , CaCl2 , ou les concentrations de KCl pourraient entraîner la baisse du taux dynamique Hoch_5815 (Fig. 3b ; Fichier supplémentaire 1 :Figure S5). Compte tenu de l'augmentation de la taille des patchs observée sous des concentrations en sel plus élevées (Fig. 3a), il apparaît que les interactions latérales entre les hexamères Hoch_5815 sont plus stables sous des concentrations en sel élevées. Modifications de CaCl2 la concentration avait une réponse plus prononcée, et il y avait un changement significatif dans le taux d'événements dynamiques entre 200 et 300 mM (Fig. 3b), alors que les réponses aux changements de MgCl2 et KCl sont relativement similaires, cohérents avec les changements de la taille du patch (Fig. 3a). Fait intéressant, les proportions les plus élevées d'événements d'assemblage par rapport aux événements de désassemblage ont été observées sous 400 mM de MgCl2 , CaCl2 , ou KCl (Fichier supplémentaire 1 :Tableau S2). Cela a conduit à la formation d'assemblages Hoch_5815 monocouches volumineux et stables sous 400 mM de sel (Fichier supplémentaire 1 :Figure S4). Les assemblages à double couche observés à 500 mM sont également stables et présentent de faibles taux de mouvement de l'hexamère.
Flexibilité de l'assemblage de protéines BMC-H
En réduisant la force de balayage à 100 pN, nous avons minimisé les effets du balayage de la pointe AFM sur l'assemblage des protéines BMC et obtenu des images AFM de résolution moléculaire des hexamères individuels (Fig. 4). Les événements d'assemblage et de désassemblage peuvent être vus dans la même vue, vérifiant la nature dynamique des assemblages de coques BMC au lieu des artefacts de numérisation de pointe [12]. L'imagerie HS-AFM a également révélé la variabilité des agrégations de protéines Hoch_5815. Lors de l'imagerie des échantillons à pH 7,5 en présence de seulement 10 mM de MgCl2 , étonnamment, nous avons occasionnellement observé la formation de structures de type fibre avec le désassemblage des hexamères Hoch_5815 à la deuxième échelle de temps (Fig. 4a). Ces structures de type fibre pourraient être densément emballées en parallèle, de la même manière que les faisceaux de nanotubes assemblés par des hexamères en coque [13,14,15,16]. Cependant, l'espace entre deux fibres est de 3,72 ± 0,31 nm (n = 30) et leur hauteur moyenne est de 2,46 ± 0,22 nm (n = 30), inférieur à celui des feuilles de coque formées par les hexamères Hoch_5815 (3,45 ± 0,16 nm, n = 25) (Fig. 4b–f). Ces structures de fibres sont assez flexibles et dynamiques pendant l'imagerie et pourraient afficher des architectures droites ou enroulées avec différentes tailles. Compte tenu de l'apparition concomitante des structures fibreuses avec le désassemblage des hexamères Hoch_5815 et de leur hauteur réduite par rapport aux feuilles d'hexamères monocouches, nous supposons que ces structures fibreuses sont formées par les peptides individuels Hoch_5815 désassemblés des hexamères (Fig. 4g) . Il est probable que l'absorption du substrat dans des conditions tampons spécifiques (telles qu'une faible force ionique) pourrait conduire à la fixation des côtés de l'hélice alpha des peptides Hoch_5815 à la surface du substrat et à la liaison linéaire des peptides avec les peptides voisins, bien qu'il soit supposé que les interactions intra-hexamères sont probablement fortes [5]. Le mécanisme détaillé sous-jacent à la variabilité de l'agrégation des protéines shell reste à élucider davantage.
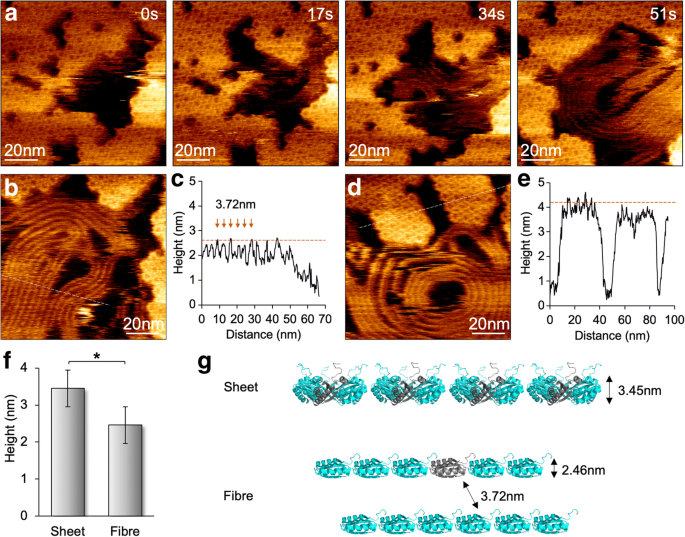
Formation et dynamique des structures fibreuses ainsi que des assemblages de tôles coques sous HS-AFM. un Apparition de structures fibreuses lors du démontage de feuilles de coque composées d'hexamères Hoch_5815, comme le montre la série d'images AFM. b Topographe AFM des structures fibreuses. c Analyse en coupe (ligne pointillée dans le panneau b ) révèle un espacement de 3,72 ± 0,31 nm (n = 30) entre les structures fibreuses adjacentes, et la hauteur moyenne est de 2,46 ± 0,22 nm (n = 30). d Topographe AFM de patchs shell composés d'hexamères Hoch_5815. e Analyse en coupe (ligne pointillée dans le panneau d ) révèle que la hauteur moyenne des hexamères Hoch_5815 est de 3,45 ± 0,16 nm (n = 25). f Les structures fibreuses présentent une hauteur réduite par rapport aux feuilles plates constituées d'hexamères Hoch_5815 (*p < 0,05, ANOVA à deux facteurs). g Organisation et formation proposées de la structure fibreuse, représentant une chaîne de monomères Hoch_5815
Discussion
Les BMC comprennent des centaines de protéines qui s'auto-assemblent pour former les structures les plus ordonnées. L'enveloppe BMC, constituée de nombreux homologues de protéines, est un système idéal pour étudier l'auto-assemblage et les interactions des protéines. En tant que technique puissante pour analyser l'organisation de la biomembrane, l'assemblage des protéines et les interactions physiques qui sont très pertinentes pour les rôles physiologiques des systèmes biologiques [32, 35, 38, 39], l'AFM a été exploitée pour visualiser l'organisation et la dynamique d'auto-assemblage de Les protéines shell BMC et les architectures et caractéristiques mécaniques des structures BMC [12, 30, 31, 40, 41, 42]. Ce travail représente, à notre connaissance, la première détermination quantitative de la dynamique d'auto-assemblage des protéines shell BMC dans la formation de feuillets bidimensionnels en réponse aux changements environnementaux en utilisant l'AFM. Les résultats mettent en évidence la variabilité inhérente et la dépendance environnementale de l'auto-assemblage de la protéine BMC-H. Par rapport à EM et DSL, l'AFM présente un grand potentiel pour surveiller les actions dynamiques de l'auto-assemblage des protéines BMC en temps réel avec des détails moléculaires.
Les interactions protéine-protéine sont d'une importance significative dans la formation et la mise en forme de la coque BMC [10]. La concentration en protéines a également été documentée comme un facteur critique pour la formation de la coquille [41, 43]. De plus, des études de solubilité in vitro ont montré que le pH et la force ionique en solution pouvaient influencer la stabilité structurelle des BMC [17, 27] ainsi que les comportements d'assemblage des protéines de la coque des BMC dans la formation de feuillets bidimensionnels [37, 41 ], les nanotubes [13, 17] et les nanocages [28], rappelant leur impact sur l'assemblage de la capside du virus [44, 45]. Nous avons également trouvé une précipitation de protéines et aucune formation de plaques lorsque pH > 10 et < 3 ou la concentration en sel < 10 mM ou> 600 mM (données non publiées). Ici, nous avons en outre montré que la tendance et la dynamique de l'assemblage dépendent du pH et de la concentration en sel. Bien que les protéines de la coquille puissent s'auto-assembler dans une large gamme de pH, l'environnement à pH neutre semble être capable d'améliorer la dynamique d'assemblage (Fig. 2b). Les cations avec une concentration 300 mM se sont avérés favoriser la formation de feuillets bidimensionnels; Les cations 400 mM semblent être souhaitables pour la formation de feuilles monocouches grandes et stables (Fig. 3). Ces conditions s'alignent sur les conditions cytosoliques des cellules bactériennes et sont physiologiquement pertinentes. Par exemple, dans la plupart des conditions physiologiquement pertinentes, le pH de E. coli le cytosol est d'environ 7,4 à 7,8 [46] et la concentration en ions est d'environ 100 à 400 mM, ce qui est vital pour les interactions protéiques, la liaison protéine-ligand, la signalisation, le maintien des potentiels électrostatiques membranaires et le gradient protéique à travers les membranes [47, 48]. Bien que la façon dont les interactions entre les échantillons et le substrat de mica affectent l'auto-assemblage des protéines BMC reste à étudier, l'imagerie AFM nous offre l'opportunité d'analyser quantitativement les changements dynamiques de l'auto-assemblage des protéines BMC en réponse aux variations environnementales.
La dynamique d'assemblage dépendante de l'environnement des protéines BMC dans la formation de fragments de coquille décrite ici pourrait représenter leurs comportements dans la formation de l'ensemble du BMC. En fait, les structures BMC 3D semblent être les organites maintenus dynamiquement conçus dans la nature. Les BMC présentent une flexibilité structurelle et une hétérogénéité notables; la douceur mécanique des structures de coque BMC déterminée par nanoindentation AFM [30] et la dynamique de non-équilibre de l'assemblage de BMC révélée par des simulations informatiques [49] ont mis en évidence les différences entre les BMC et les assemblages de virus robustes. De même, la biosynthèse des carboxysomes a été élucidée pour être corrélée à la lumière et aux chaperons [50, 51]. Très récemment, il a été indiqué que CcmK3 et CcmK4 peuvent former des hétérohexamères et coiffer la coque du carboxysome d'une manière dépendante du pH, fournissant éventuellement un moyen de réguler la perméabilité de la coque du carboxysome et le CO2 assimilation dans le microenvironnement hautement dynamique [52]. Le mécanisme exact sous-jacent à la façon dont les conditions environnementales en solution affectent l'assemblage thermodynamique des protéines BMC reste à étudier, par exemple, en utilisant une combinaison d'études expérimentales et de simulations informatiques.
Compte tenu de l'auto-assemblage des structures BMC, il existe un intérêt important pour l'ingénierie des BMC et la conception de nouveaux nanobioréacteurs à base de BMC, d'échafaudages moléculaires et de biomatériaux dans les applications biotechnologiques, par exemple, l'amélioration du métabolisme cellulaire, l'encapsulation d'enzymes, l'administration moléculaire et la thérapie. . Les connaissances avancées sur la résilience structurelle et la variabilité des BMC en réponse aux changements environnementaux n'éclaireront pas seulement les stratégies de production de nanostructures robustes à base de BMC dans des hôtes hétérologues, c'est-à-dire E. coli ou des plantes [31, 53, 54], mais ouvrent également la voie à la modulation de la formation de nanomatériaux 2D ainsi que l'ouverture et la fermeture de cages protéiques à base de coquilles BMC, facilitant ainsi la régulation fonctionnelle et l'administration moléculaire ciblée. Auparavant, nous avons démontré la faisabilité d'utiliser une approche de modification génétique pour manipuler les contacts spécifiques aux interfaces des protéines de la coque et leurs comportements d'auto-assemblage [12]. Cette étude renforce notre boîte à outils pour évaluer et manipuler l'auto-assemblage de coque BMC dans divers environnements.
Conclusions
En résumé, nous avons exploité le HS-AFM pour mener des enquêtes quantitatives sur l'auto-assemblage de la protéine shell BMC dans différentes conditions de pH et de sel. Il a été démontré que la formation de plus grandes plaques monocouches d'hexamères en coquille était favorisée à une concentration en sel de 400 mM, et un pH neutre a entraîné un taux dynamique plus élevé d'auto-assemblage d'hexamères. La transition organisationnelle des protéines de la coquille des assemblages hexamériques aux matrices de type fibre a également été visualisée. Cette étude a illustré que les conditions environnementales jouent un rôle important dans la détermination de l'organisation et de l'auto-assemblage des protéines de la coque BMC.
Abréviations
- BMC :
-
Microcompartiment bactérien
- BMC-H :
-
Hexamère du microcompartiment bactérien
- BMC-P :
-
Microcompartiment bactérien pentamère
- BMC-T :
-
Trimère des microcompartiments bactériens
- DSL :
-
Diffusion dynamique de la lumière
- E. coli :
-
Escherichia coli
- EM :
-
Microscopie électronique
- HS-AFM :
-
Microscopie à force atomique à grande vitesse
Nanomatériaux
- Évaluer l'IoT et l'impact de la 5G
- Innovation dans les réseaux privés :configurer et modifier la bande passante et la durée à la volée
- Dévoilement de la structure atomique et électronique des nanofibres de carbone empilées
- Étude des premiers principes sur la stabilité et l'image STM du borophène
- Synthèse facile d'oxyde d'étain mésoporeux semblable à un trou de ver via l'auto-assemblage induit par l'évaporation et les propriétés de détection de gaz améliorées
- Robots, cobots et automatisation :la pandémie propulse-t-elle une vague de changement dans le secteur manufacturier ?
- Comment le rebond de la fabrication modifiera le recrutement et la rétention des employés
- L'impact environnemental de la fabrication, de la révolution industrielle à l'automatisation et tout le reste
- L'automatisation et les robots vont-ils changer le monde ?



