Comportement de détection de WS2 bidimensionnels dopés à l'Al et au P vers le NO, le NO2 et le SO2 :une étude Ab Initio
Résumé
Dichalcogénures de métaux de transition bidimensionnels (TMD 2D), tels que WS2 , sont considérés comme ayant le potentiel pour des capteurs de gaz haute performance. C'est dommage que l'interaction entre les gaz et le WS 2D vierge2 car l'élément sensible est trop faible de sorte que la réponse du capteur est difficile à détecter. Ici, les capacités de détection des WS2 dopés Al et P à NON, NON2 , et SO2 ont été évalués. En particulier, nous avons pris en compte la sélectivité des gaz cibles et la concentration de dopants. Des modèles moléculaires des systèmes d'adsorption ont été construits et la théorie fonctionnelle de la densité (DFT) a été utilisée pour explorer les comportements d'adsorption de ces gaz du point de vue de l'énergie de liaison, de la structure de bande et de la densité d'états (DOS). Les résultats suggèrent que le dopage des atomes pourrait augmenter la force d'adsorption entre les molécules de gaz et le substrat. De plus, la sensibilité du WS2 dopé P à NON et NON2 n'a pratiquement pas été affecté par le CO2 ou H2 O. La sensibilité du WS2 dopé à l'Al à NON2 et SO2 était également difficile d'être affecté par le CO2 ou H2 O. Pour AUCUNE détection, le WS2 avec une concentration de dopant de 7,4 % avait de meilleures propriétés sensibles que celle avec une concentration de dopant de 3,7 %. Tandis que pour SO2 , le résultat était exactement le contraire. Ce travail a fourni une référence complète pour le choix des dopants appropriés (concentration) dans les matériaux 2D pour la détection des gaz nocifs.
Introduction
L'oxyde d'azote et le dioxyde de soufre sont largement utilisés dans la production industrielle. Par exemple, l'oxyde nitrique (NO) pourrait être utilisé comme source d'azote pour les processus de dopage dans l'industrie des semi-conducteurs, et le dioxyde de soufre (SO2 ) pourrait être utilisé pour empêcher la détérioration du raisin [1]. Cependant, ces gaz sont non seulement nocifs mais pourraient également causer de graves problèmes environnementaux, tels que les pluies acides ou le smog photochimique [2, 3]. Il est nécessaire de surveiller les fuites de ces gaz dans les applications industrielles. Parmi les recherches précédentes, les capteurs de gaz à oxyde métallique ont été largement étudiés, mais ils présentent des inconvénients d'instabilité et des conditions de travail limitées [4]. Par conséquent, il est d'une importance considérable de trouver de nouveaux matériaux pour détecter ces gaz [5]. Pour détecter efficacement les molécules de gaz, les matériaux doivent avoir un rapport volumique de surface élevé et une force de liaison suffisante pour adsorber les molécules de gaz [6, 7]. La découverte des propriétés de détection du graphène et des gaz rares [8] a motivé les chercheurs à porter leur attention sur les matériaux 2D [9, 10].
Parmi les matériaux 2D, les disulfures de métaux de transition (TMD) ont suscité de nombreuses inquiétudes dans le domaine de la détection de gaz en raison de leurs propriétés semi-conductrices stables et de la mobilité appropriée des porteurs [11,12,13]. Surtout en tant que type typique de TMD, WS2 possède diverses propriétés uniques pour les matériaux de détection [14, 15], telles qu'une excellente stabilité thermique, une structure de bande accordable [16, 17] et un faible coût. Cependant, un WS 2D vierge2 en tant qu'élément sensible présente certains inconvénients, tels qu'une faible adsorption avec les gaz cibles, qui ne peuvent pas capturer efficacement les molécules de gaz [18]. Dans ce cas, le dopage est largement utilisé dans les matériaux 2D pour ajuster les propriétés de surface et la force de liaison entre les matériaux et les molécules de gaz et améliorer la capacité d'adsorption et de détection des gaz [19, 20]. Bien entendu, différents dopants ont des effets différents sur les performances de détection. Par conséquent, les substrats sensibles dopés doivent trouver des impuretés appropriées pour améliorer leurs performances de détection. Par exemple, WS2 dopé au Pd a déjà montré leur amélioration par rapport à leurs homologues vierges dans la détection de gaz [6, 21]. Malheureusement, la plupart des études précédentes sur le WS dopé2 car l'élément sensible s'est uniquement concentré sur la force de liaison et le transfert de charge entre les molécules de gaz et les films monocouches. La sélectivité d'adsorption aux gaz et l'influence de la concentration de dopage sont souvent négligées. Dans ce travail, nous avons exploré de manière approfondie non seulement la force de liaison et le transfert de charge, mais également la sélectivité d'adsorption vis-à-vis des gaz cibles et l'influence des concentrations de dopage.
Ici, étant donné que les atomes Al et P ont un rayon covalent proche et une structure électronique similaire avec les atomes S, il leur est plus facile de remplacer les atomes S et de former une structure covalente stable. De nombreuses études antérieures ont étudié des matériaux avec dopage par substitution des atomes S [22,23,24,25]. Par conséquent, ce travail a exploré les performances de détection des WS2 dopés à l'Al et au P. avec l'aide de DFT. Les propriétés de détection des systèmes dopés avec celles du système non dopé ont été comparées en termes d'énergie de liaison, de structure de bande et de densité d'état. Il a prouvé que WS2 dopé avec des atomes d'Al ou de P présentait des avantages apparents par rapport au WS2 vierge dans la détection de ces gaz. En plus de NON, NON2 , et SO2 , nous avons pris en compte le CO2 et H2 O comme gaz perturbateurs pour examiner la sélectivité d'un substrat dopé vis-à-vis des gaz cibles. Deux concentrations de dopage, 3,7 % et 7,4 %, ont été considérées pour estimer son influence sur la sensibilité aux gaz. Ce travail fournit un aperçu complet pour sélectionner les dopants appropriés (concentration) dans les matériaux 2D pour détecter les gaz nocifs.
Méthodes
Dans ce travail, tous les calculs de premier principe étaient basés sur la DFT [26, 27]. L'approximation de la densité locale (LDA) avec la fonction PWC a été sélectionnée pour traiter l'échange d'électrons et la corrélation. Pour alléger la charge de calcul, le noyau (pseudopots semi-cœurs DFT) a été remplacé par un seul potentiel effectif. Un double jeu de bases orbitales numériques et une fonction de polarisation orbitale (DNP) ont été choisis. Le rayon de coupure orbital global a été fixé à 4,9 Å pour assurer une précision suffisante. Les points k de Monkhorst-Pack ont été fixés à 4 × 4 × 1 après un test de convergence, avec une couche de vide de 13,4 pour éviter l'interaction entre les unités adjacentes. La précision de convergence d'énergie pour la géométrie était de 1,0 × 10 −5 Hartree, tandis que le déplacement maximal était de 0,005 Å et la force maximale de 0,002 Hartree/Å.
Une supercellule 3 × 3 × 1 contenant des atomes 9 W et des atomes 18 S a été établie, comme le montre la figure 1a. Pour les modèles de WS2 dopés , un atome S a été remplacé par un atome P ou Al [28], comme le montre la figure 1b–d. Ensuite, une optimisation géométrique a été donnée. Après cela, la molécule de gaz a été placée au-dessus du WS2 plan pour construire le modèle d'adsorption de gaz. Trois sites pour la molécule de gaz adsorbé ont été choisis. Ils étaient le sommet des atomes S ou dopants (I), le sommet du point médian de la liaison entre l'atome dopé et l'atome W ou S (II), et le centre de la structure hexagonale (III), comme indiqué dans le Fig. 1a–c. Après les optimisations géométriques pour chaque système d'adsorption, les constructions géométriques avec l'adsorption de gaz la plus stable ont été trouvées. L'énergie de liaison (E lier ) pourrait refléter l'interaction entre le matériau et la molécule de gaz adsorbé et être calculé par la fonction suivante :
$$ {E}_{bind}={E}_{tot}-{E}_m-{E}_{gas} $$ (1)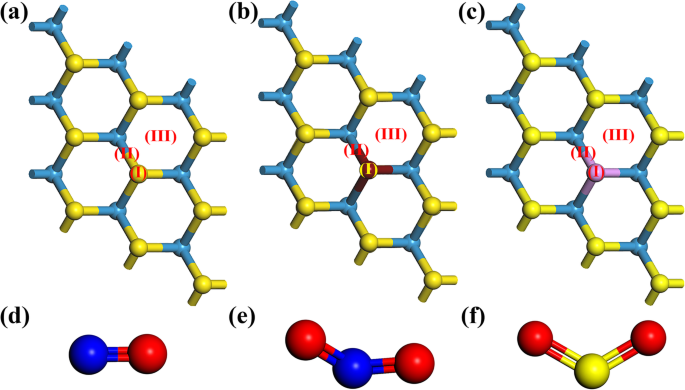
Le modèle supercellulaire 4 × 4 × 1 de a WS vierge2 , b WS2 dopé à l'Al , et c WS2 dopé P avec les trois sites d'adsorption marqués. Et les modèles de d NON, e NON2 , et f SO2 molécules. Les boules jaunes, bleu clair, rouge foncé, violettes, bleues et rouges représentent respectivement S, W, Al, P, N et O
où E m représente l'énergie du matériau sans adsorber les molécules de gaz, E tot représente l'énergie totale du matériau et des molécules de gaz, et E gaz représente l'énergie de la molécule de gaz isolée [29]. Une valeur absolue plus considérable de E lier représente une force d'interaction plus puissante entre le matériau et les molécules de gaz.
L'énergie de formation (E fm ), ce qui pourrait refléter la difficulté de former un système de dopage, et la stabilité du système a été calculée par la fonction ci-dessous :
$$ {E}_{fm}={E}_{tot}+{E}_s-{E}_m-{E}_{dopant} $$ (2)où E s est l'énergie totale de l'atome S substitué, et E dopant représente l'énergie totale des atomes dopants. Une valeur plus significative de E fm signifie plus difficile de former le système dopant.
Résultats et discussion
Les positions d'adsorption ont été montrées sur les figures 1a–c, qui correspondaient à des WS2 vierges, dopés à l'Al et dopés au P. , respectivement. Sur la figure 1,d–f, les longueurs de liaison de N–O, N=O et S=O étaient respectivement de 1,16 Å, 1,21 Å et 1,46 Å. La longueur de liaison des liaisons W–S, Al–W et P–W était d'environ 2,43 Å, 2,86 Å et 2,45 Å, respectivement. Après l'optimisation géométrique, le site énergétiquement favorable pour chaque adsorbat a été utilisé dans la discussion suivante. Les énergies de liaison du WS2 dopé à 3,7% P et Al système au site énergétiquement favorable ont été présentés dans le tableau 1. L'énergie de liaison du pur WS2 système a été présenté dans le tableau S1. Ensuite, selon les résultats de l'énergie de liaison, l'interaction entre les molécules de gaz et le pur WS2 était si faible qu'il était difficile pour le matériau du substrat d'adsorber les molécules de gaz de manière stable. L'énergie de liaison du NO-primine WS2 système était même positif. Cependant, l'introduction de dopant pourrait améliorer considérablement la force d'adsorption entre le gaz et le WS2 , en particulier pour WS2 dopé par l'atome d'Al. Parmi tous les cas de dopage, la force d'adsorption était la plus faible, tandis que SO2 adsorbé sur P–WS2 . Par ailleurs, outre Al et P, d'autres éléments de la même période ou famille avec S, tels que O, Si, Cl ou Se, ont également été considérés. Le cas du WS2 substitué par W dopé au Fe a été montré dans la Fig. S1, tandis que WS2 les systèmes avec ces dopants avaient soit une mauvaise stabilité (haute E fm ) ou une interaction faible avec des molécules de gaz. Compte tenu de cela, ces dopants n'ont pas été impliqués dans les études ultérieures. Les sites énergétiquement favorables (l'énergie de liaison négative la plus basse) de NO, NO2 , et SO2 molécules adsorbées sur le WS2 dopé ont été montrés dans les Fig. S2, S3 et S4, respectivement.
Les structures de bande de monocouche vierge et dopée Al et P WS2 ont été présentés dans la Fig. 2. Les résultats de la densité projective d'états (PDOS) ont été montrés dans la Fig. S5. La monocouche 2H WS2 est un semi-conducteur avec une bande interdite directe au point Γ. Pour WS2 dopée avec de l'atome d'Al, l'impureté a introduit des états d'interface dans la région de la bande interdite de la monocouche 2H WS2 . De plus, la présence d'un atome de métal forme la barrière Schottky avec le niveau de Fermi épinglé dans la région de surface du semi-conducteur. La position d'épinglage est à moins de 0,2 eV du niveau de Fermi du premier semi-conducteur [5]. Les propriétés des métaux sont apportées par les dopants métalliques [30]. En même temps, l'atome P a introduit des bandes d'énergie mélangées à la bande de conduction et de cantonnière de WS2 . Structures de bande de WS dopés2 après l'adsorption de gaz ont été montrés dans la Fig. S6. Par conséquent, dans les cas de NO sur WS2 dopé Al , NON sur WS2 dopé P , et SO2 sur WS2 dopé à l'Al , la largeur de bande interdite du matériau avait un changement évident après que les molécules de gaz aient été adsorbées. Des études antérieures ont montré qu'une bande interdite réduite signifie une stabilité cinétique plus faible, une activité chimique plus élevée et une transition électronique plus naturelle de la bande de valence à la bande de conduction [31, 32]. Ainsi, après adsorption de gaz, des changements évidents de bande interdite des matériaux dopés ont permis d'être des substrats sensibles pour détecter l'existence de molécules de gaz.
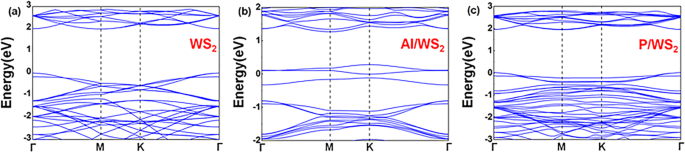
Structure de bande de a WS vierge2 , b WS2 dopé à l'Al , et c WS2 dopé P
Sur la base du transfert de charge entre les molécules de gaz et les matériaux du substrat, la détection de gaz peut être complétée par des capteurs de gaz. Selon la théorie traditionnelle du transfert de charge, le mécanisme du processus de transfert de charge entre le gaz et le WS2 a été montré dans la Fig. 3. LUMO est l'orbitale moléculaire inoccupée la plus basse, tandis que HOMO est l'orbitale moléculaire la plus haute occupée. E f est le niveau de Fermi du substrat. Si E f est entre LUMO et HOMO, il n'y aura pas de transfert de charge selon la théorie traditionnelle. Ensuite, Zhou et al. a ajouté que le mécanisme de transfert de charge serait décidé par le mélange orbital de LUMO et HOMO avec le matériau du substrat si E f se situe entre LUMO et HOMO, comme le montre la figure 3a [5]. Si le LUMO est inférieur au niveau de Fermi de WS2 , les électrons s'écouleront de WS2 à la molécule de gaz illustrée à la Fig. 3b [7]. Après avoir atteint l'état d'équilibre, le E f du système d'adsorption est le même que LUMO. Inversement, si le HOMO est supérieur au niveau de Fermi de WS2 , les électrons passeront des molécules de gaz à WS2 illustré à la figure 3c [5]. Le E f du système d'adsorption est le même que LUMO à l'état d'équilibre. Les isosurfaces LUMO et HOMO de NO, NO2 , et SO2 orbitale de la molécule ont été montrés dans la Fig. 4, a–c respectivement. L'énergie de LUMO et HOMO et E f de WS2 ont été présentés dans le tableau S2. D'après le tableau, E f entre LUMO et HOMO dans les systèmes d'adsorption dopés Al et P. Par conséquent, il est nécessaire d'explorer le mélange orbital entre le LUMO et l'HOMO des molécules de gaz et le matériau du substrat.
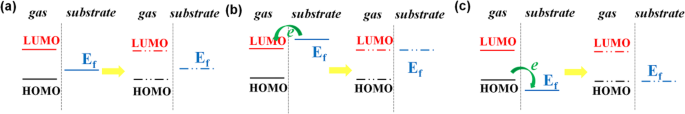
Schéma de principe du mécanisme de transfert de charges
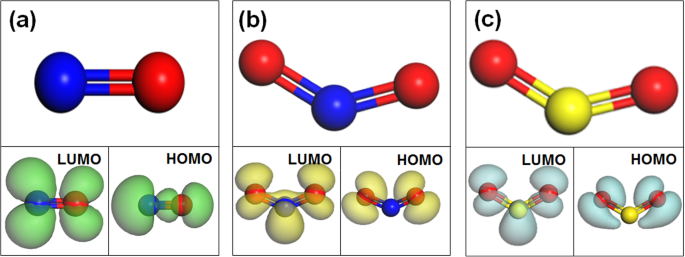
LUMO et HOMO de la molécule orbitale a NON, b NON2 , et c SO2
Le DOS a été utilisé pour discuter davantage de la distribution des électrons et du mélange orbital dans le système d'adsorption, qui dépendait de l'interaction entre les gaz et les substrats. La figure 5 présente le DOS des gaz, des dopants, des atomes S et W. Les lignes noires et rouges étaient respectivement les courbes DOS des gaz et des dopants. Et les lignes bleues et olives étaient celles des atomes S et W, respectivement. Après l'adsorption du gaz, en raison de l'interaction orbitale, la redistribution des électrons s'est produite dans l'ensemble du système, ce qui conduirait aux chevauchements des pics de DOS entre le gaz et le matériau du substrat. Les chevauchements des pics DOS signifiaient le mélange entre les orbitales moléculaires, prouvant l'existence d'une interaction entre le gaz et les matériaux de détection [33]. Le mélange des orbitales moléculaires a été utile pour le transfert de charge afin qu'il puisse augmenter l'interaction d'adsorption entre le gaz et la surface du matériau [34,35,36]. Par conséquent, le mélange entre les orbitales moléculaires a été comparé pour évaluer les effets d'adsorption des molécules de gaz. Sur la figure 5a, le mélange orbital entre la molécule de NO et l'atome d'Al était à −12,62 et −8,11 eV. Et le mélange orbital entre la molécule NO et les atomes Al, S et W était à 2,02 eV. Sur la figure 5b, le mélange orbital entre NO2 molécule et l'atome d'Al était à - 19,60, - 11,60 et - 8,44 eV. Et le mélange orbital entre NO2 molécule et les atomes Al, S et W étaient à 0 eV. Sur la figure 5c, le mélange orbital entre SO2 molécule et l'atome d'Al était à −12,09 eV. Le mélange orbital entre SO2 molécule et les atomes Al et S était à - 8,27 eV. Le mélange orbital entre SO2 molécule et les atomes Al, S et W était à 1,75 eV. Sur la figure 5d, le mélange orbital entre la molécule de NO et l'atome de P était à −12,21 eV. Et le mélange orbital entre la molécule de NO et les atomes P, S et W était à − 10 eV. Sur la figure 5e, le mélange orbital entre NO2 molécule et l'atome P était à −12,63 eV. Et le mélange orbital entre NO2 molécule et les atomes P, S et W était à - 9,66 et - 5,51 eV. Sur la figure 5f, le mélange orbital entre SO2 molécule et les atomes S était à - 9,25 eV. D'après les résultats ci-dessus, on peut constater que la présence d'impuretés entraîne un mélange plus orbital. De plus, le mélange orbital dans les systèmes avec un atome d'Al dopé est supérieur à celui des systèmes avec un atome de P dopé, ce qui indique une interaction plus forte entre les molécules de gaz et le substrat dans les systèmes dopés à l'Al qui s'accordent bien avec les résultats d'énergie excessive. En résumé, l'introduction d'impuretés peut fournir des pics plus activés dans toute la bande, augmentant ainsi la possibilité de mélange orbital entre le substrat et les molécules de gaz.
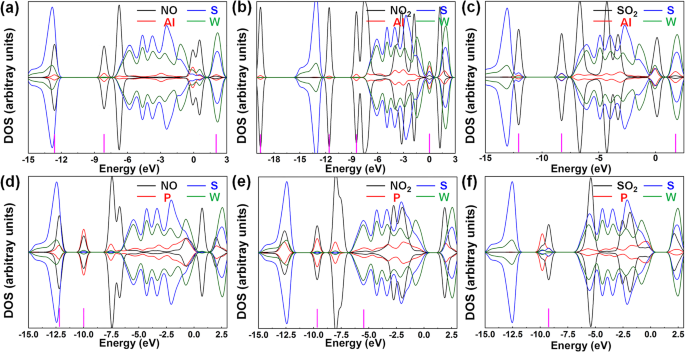
DOS de a NO, Al, S et W atomes ; b NON2 les atomes , Al, S et W ; c SO2 les atomes , Al, S et W ; d atomes NO, P, S et W ; e NON2 atomes , P, S et W; et f SO2 , P, S et W atomes
Évaluer davantage le potentiel de détection des WS2 dopés Al et P , CO2 et H2 O ont également été pris en compte pour tester la sélectivité des WS2 dopés Al et P pour cibler le gaz. Similaire à NON, NON2 , ou SO2 adsorption, le site d'adsorption le plus stable parmi trois sites avec une symétrie géométrique élevée sur WS2 a été montré dans la Fig. S7(a), (b), (c) et (d). Les résultats d'énergie de liaison ont été présentés dans le tableau S3 et les résultats de structure de bande ont été présentés sur les figures S7(e), (f), (g) et (h). La longueur de liaison de C=O dans CO2 isolé et O–H dans H2 isolé O était de 1,175 Å et 0,971 Å, respectivement. Ils n'ont pas beaucoup changé après l'adsorption du gaz sur le WS2 dopé sauf H2 O adsorbé sur Al-WS2 . Cela indiquait l'interaction entre le H2 Molécule O et WS2 dopé Al était le plus fort. Selon le tableau 2, l'énergie de liaison calculée de H2 O sur Al-WS2 était de − 1,69 eV.
Tous ces résultats indiquaient une possibilité que le WS2 dopé à l'Al aurait une mauvaise sélectivité pour cibler le gaz en présence de H2 O. Pour confirmer davantage ce point, l'analyse DOS a été effectuée, illustrée à la Fig. 6. Pour la Fig. 6b, dans le groupe de H2 O sur Al-WS2 , les chevauchements des pics DOS entre le gaz et le matériau du substrat près de E f (0 eV) étaient beaucoup plus apparents que les trois autres. Cela s'est avéré une forte interaction et plus de possibilité de transfert de charge entre H2 Molécule O et Al-WS2 . De plus, un mélange plus orbital entre les H2 La molécule O et l'atome Al ont pu être trouvés, ce qui a fourni plus de preuves de l'interaction. De ceux-ci, nous pourrions conclure que le WS2 dopé à l'Al car le matériel de détection serait facilement affecté par H2 O. L'énergie de liaison était de − 0,18 et − 0,27 eV avec CO2 et H2 O adsorbant sur WS2 dopé P , respectivement. Ces résultats étaient inférieurs à l'énergie de liaison du NO (− 0,87 eV) et du NO2 (− 1.27 eV) mais très proche de l'énergie de liaison du SO2 (− 0.29 eV) sur WS2 dopé P . Sur la figure 6c, le mélange orbital entre CO2 molécule et l'atome P était à −12,63 et −9,66 eV. Sur la figure 6d, le mélange orbital entre H2 La molécule O et les atomes S étaient à - 9,25 eV. Par conséquent, la sensibilité du WS2 dopé P à SO2 a été facilement effectuée en présence de CO2 ou H2 O lorsque l'énergie de liaison et le mélange orbital ont été pris en compte simultanément.
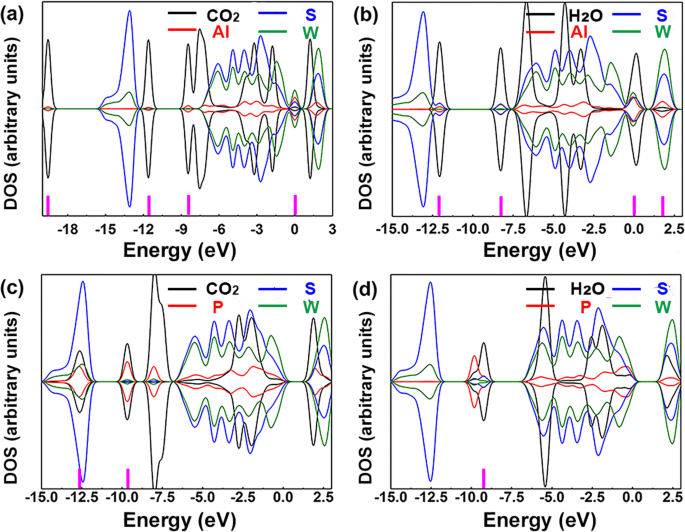
DOS de a CO2 les atomes , Al, S et W ; b H2 atomes O, Al, S et W ; c CO2 atomes , P, S et W; et d H2 Atomes O, P, S et W
Le dopage à un seul atome (3,7% de concentration de dopage) a été discuté dans les parties ci-dessus. Considérant que différentes concentrations de dopage avaient un impact sur les performances de détection, le cas du dopage diatomique (concentration de dopage à 7,4%) a également été discuté dans le 3 × 3 WS2 maquette. Les atomes S étaient encore remplacés par des atomes dopants. Il y avait quatre situations pour les emplacements de dopage illustrés à la figure S8. Pour le WS2 dopé à l'Al , ils ont été nommés respectivement 2Al-1, 2Al-2, 2Al-3 et 2Al-4. Pour le WS2 dopé P , ils ont été nommés respectivement 2P-1, 2P-2, 2P-3 et 2P-4. Ensuite, l'énergie de formation de chaque système dopant a été calculée pour évaluer la difficulté de former ces structures. Plus la formation d'énergie est faible, plus la formation de configuration est facile. Les résultats de la formation d'énergie ont été présentés dans le tableau S4. La structure 2Al-1 a été choisie car elle a la plus faible énergie de formation parmi les quatre cas. De même, 2P-1 et 2P-3 ont tous deux été choisis car ils ont des énergies de formation adjacentes.
D'après les résultats de la structure des bandes (Fig. S6), WS2 dopé Al avait d'excellentes performances d'adsorption sur NO et SO2 que NON2 lorsque la concentration de dopage était de 3,7%. Et WS2 dopé P avait des performances d'adsorption supérieures à NO que NO2 et SO2 . Par conséquent, pour le WS2 dopé à l'Al , uniquement NO et SO2 ont été pris en compte lorsque la concentration de dopage était de 7,4 %. Pour WS2 dopé P , seul le NON a été pris en compte. Sur cette base, l'influence de la concentration de dopage sur les performances d'adsorption a été explorée. Les structures d'adsorption les plus stables ont été montrées sur la figure S9 et ont montré que les résultats d'énergie de liaison ont été montrés dans le tableau S5. Les DOS de ces systèmes ont été présentés sur la figure 7. Sur la figure 7a, le mélange orbital entre la molécule de NO et les atomes d'aluminium était respectivement de − 6,51, − 3,25 et − 0,75 eV. Le mélange orbital entre la molécule NO et S, ainsi que les atomes W, était à 1,78 eV. Sur la figure 7b, le mélange orbital entre SO2 molécule et les atomes S était à - 19,69 eV. Le mélange orbital entre SO2 molécule et S, ainsi que les atomes d'Al, était à - 10,91 eV. Sur la figure 7c, le mélange orbital entre la molécule de NO et les atomes de P était à −7,67 eV. Le mélange orbital était à - 0.86 eV entre la molécule NO et les atomes P ainsi que W. Le mélange orbital était à − 2,39 eV entre la molécule NO et les atomes P, S, ainsi que W. Sur la figure 7d, le mélange orbital entre la molécule de NO et les atomes de W était respectivement de −12,55 et −0,76 eV. En comparant la figure 7a avec la figure 5a, on peut observer que le mélange orbital et l'énergie de liaison se sont renforcés, ce qui indiquait une concentration de dopage à 7,4% en Al induit une performance d'adsorption de NO supérieure à 3,7%. En comparant la figure 7b avec la figure 5c, le mélange orbital et l'énergie de liaison se sont affaiblis, ce qui suggère que la concentration de dopage à 7,4% d'Al a causé un SO2 plus pauvre performance d'adsorption supérieure à 3,7%. Et l'énergie de liaison négative du système 2P-1 était inférieure à celle de 2P-3, selon le tableau S5. Par conséquent, les performances d'adsorption du système 2P-3 étaient plus faibles que celles du système 2P-1, du point de vue de l'énergie de liaison et du mélange orbital, puis, en comparant la structure 2P-1 avec la figure 5d. En comparant la figure 7c avec la figure 5d, le mélange orbital et l'énergie de liaison ont été renforcés et cela indiquait qu'une concentration de dopage P de 7,4% peut être améliorée avec une meilleure performance d'adsorption de NO que 3,7%. Pour résumer, il a pu être observé que l'influence de différentes concentrations de dopage sur les performances de détection des WS dopés P2 était inférieur à celui du WS2 dopé à l'Al .
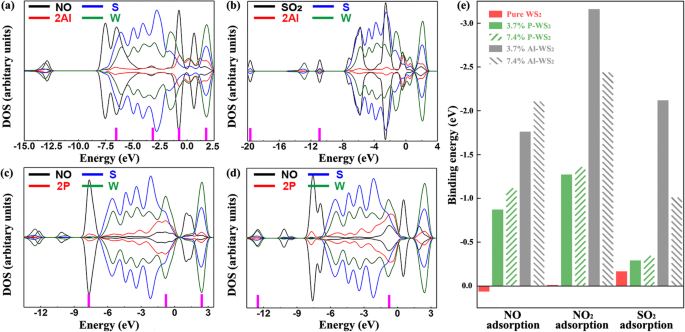
DOS de a atomes de NO, 2Al-1, S et W ; b SO2 , les atomes 2Al-1, S et W ; c NO, atomes 2P-1, S et W ; et d NO, 2P-3, S et W atomes. e Energies de liaison de tous les systèmes d'adsorption
D'autre part, les énergies de liaison de tous les systèmes d'adsorption ont été représentées sous la forme d'un graphique en colonnes sur la figure 7e. Selon la figure 7e, les deux concentrations de dopage à 3,7 % et à 7,4 % pourraient améliorer la force d'adsorption du système par rapport au WS2 pur. système. Pour les systèmes dopés avec deux atomes de P, un dopage de 7,4% a amélioré la force d'adsorption de plus de 3,7% de dopage, en particulier pour l'adsorption de gaz NO. Pour les systèmes dopés avec deux atomes d'aluminium, la force d'adsorption sur le gaz NO a augmenté. Tandis que la force d'adsorption au SO2 ou NON2 diminué, et que dans les cas avec SO2 diminué plus que les cas avec NO2 . Dans l'ensemble, l'augmentation de la concentration de dopage a eu une plus grande influence sur la force d'adsorption des systèmes dopés Al que ceux dopés P.
Conclusion
Dans ce travail, en utilisant les premiers principes, des calculs théoriques ont été effectués pour évaluer l'influence des dopants Al et P et leur concentration de dopage sur les performances sensibles de WS2 vers NON, NON2 , et SO2 molécule. Les travaux ont également exploré la sélectivité envers les gaz cibles en présence de CO2 et H2 O gaz. Pour la structure de bande après adsorption de gaz, le changement de bande interdite et de faibles niveaux près du niveau de Fermi signifiait WS2 dopé avait un grand potentiel pour être utilisé comme capteur de gaz de type résistance vers NO ou SO2 . Selon les résultats de l'énergie de liaison, les WS2 dopés à l'Al et au P avait une énergie de liaison négative aux molécules de gaz inférieure à celle du WS2 vierge , indiquant l'amélioration de la force d'adsorption en raison de la présence d'impuretés. Le DOS a montré que l'impureté pouvait générer davantage de pics activés et stimuler de manière significative le mélange orbital entre le gaz et le substrat pour améliorer la sensibilité du matériau du substrat. Par conséquent, il y avait plus de transfert de charge et une interaction de liaison plus forte entre les molécules de gaz et le WS2 dopé Matériel. De plus, la sensibilité du WS2 dopé P à NON et NON2 était presque impossible d'être affecté par le CO2 et H2 O, tandis que cela à SO2 serait modifié en présence de CO2 ou H2 O. La sensibilité du WS2 dopé à l'Al à NON a été facilement affecté par H2 O mais difficile d'être influencé par le CO2 . Cependant, la sensibilité du WS2 dopé à l'Al à NON2 et SO2 était difficile d'être affecté par le CO2 et H2 O. Pour la détection de NO, le WS2 dopé Al et P avec une concentration de dopant de 7,4 % avait de meilleures propriétés sensibles qu'avec une concentration de dopant de 3,7 %. Tandis que pour SO2 détection, WS2 dopé Al avec une concentration de dopant de 7,4 % avait une performance de réponse d'affaiblissement plus prononcée qu'avec une concentration de dopant de 3,7 %. L'influence de la concentration de dopage sur les performances de détection des WS2 dopés P était plus petit que celui du WS2 dopé à l'Al . Par conséquent, nos calculs complets pourraient fournir aux matériaux bidimensionnels dopés une référence précieuse pour la détection des gaz nocifs.
Disponibilité des données et des matériaux
Toutes les données sont entièrement disponibles sans restriction.
Abréviations
- 2D :
-
Deux dimensions
- TMD :
-
Disulfures de métaux de transition
- DFT :
-
Théorie fonctionnelle de la densité
- LDA :
-
Approximation de la densité locale
- DNP :
-
Double numérique plus polarisation
- DOS :
-
Densité d'états
- PDOS :
-
Densité partielle d'états
- LUMO :
-
Orbitale moléculaire inoccupée la plus basse
- HOMO :
-
Orbitale moléculaire la plus occupée
Nanomatériaux
- Vers les nanofluides TiO2—Partie 1 :Préparation et propriétés
- Vers les nanofluides TiO2 – Partie 2 :Applications et défis
- Étude des premiers principes sur la stabilité et l'image STM du borophène
- Étude in vitro de l'influence des nanoparticules Au sur les lignées cellulaires HT29 et SPEV
- Étude collective sur la modélisation et la simulation de mémoires résistives à accès aléatoire
- Une étude sur les nanofibres de carbone et le charbon actif en tant que supercondensateur symétrique dans l'électrolyte aqueux :une étude comparative
- Synthèse et étude in vitro d'une sonde bimode ciblant l'intégrine αvβ3
- Étude in situ de diffraction des rayons X à haute pression et de spectroscopie Raman du Ti3C2Tx MXene
- Conductivité thermique de deux types d'allotropes de carbone 2D :une étude de dynamique moléculaire



