Nanomatériaux de carbone pour le traitement de l'eau contaminée par des métaux lourds et la dépollution de l'environnement
Résumé
La nanotechnologie est un domaine scientifique avancé ayant la capacité de résoudre une variété de défis environnementaux en contrôlant la taille et la forme des matériaux à l'échelle nanométrique. Les nanomatériaux de carbone sont uniques en raison de leur nature non toxique, de leur surface spécifique élevée, de leur biodégradation plus facile et de leur assainissement de l'environnement particulièrement utile. La contamination par les métaux lourds dans l'eau est un problème majeur et pose un grand risque pour la santé humaine. Les nanomatériaux de carbone attirent de plus en plus l'attention en raison de leurs propriétés physico-chimiques supérieures qui peuvent être exploitées pour le traitement avancé de l'eau contaminée par des métaux lourds. Les nanomatériaux de carbone, à savoir les nanotubes de carbone, les fullerènes, le graphène, l'oxyde de graphène et le charbon actif ont un grand potentiel pour l'élimination des métaux lourds de l'eau en raison de leur grande surface, de leur taille nanométrique et de la disponibilité de différentes fonctionnalités et ils sont plus faciles à modifier chimiquement et recyclé. Dans cet article, nous avons passé en revue les avancées récentes dans les applications de ces nanomatériaux de carbone dans le traitement de l'eau contaminée par des métaux lourds et avons également mis en évidence leur application dans l'assainissement de l'environnement. Les aspects toxicologiques des nanomatériaux à base de carbone ont également été discutés.
Introduction
La pollution est définie comme la présence d'entités chimiques indésirables empêchant le processus naturel ou provoquant des effets néfastes sur les organismes vivants et l'environnement [1,2,3]. L'industrialisation et l'immense augmentation de la population entraînant une urbanisation croissante provoquent l'augmentation de la pollution à un rythme alarmant [2, 4]. Améliorer la qualité de l'eau, du sol et de l'air est un immense défi de l'ère moderne. L'identification et le traitement des polluants environnementaux et leur prévention est une étape clé dans la protection de l'environnement. La science des matériaux joue un rôle essentiel dans la réalisation de l'objectif environnemental propre, et la technologie de la science des matériaux a progressé de façon exponentielle au cours de la dernière décennie, en particulier les nanomatériaux [1, 5]. L'eau pure et propre se raréfie en raison de l'industrialisation et le monde est confronté à une pénurie d'eau propre, en particulier dans les pays en développement [6]. Les contaminants de l'eau peuvent être des substances organiques, des bactéries, des virus, des colorants et des ions de métaux lourds tels que le plomb, le cadmium, le zinc, le nickel, l'arsenic, le chrome et le mercure avec une nature non biodégradable posant un grand risque pour la santé humaine. Les ions de métaux lourds peuvent provoquer de nombreux effets indésirables comme le cancer, les lésions rénales, l'hépatite, les fausses couches, l'anémie, l'encéphalopathie et le syndrome néphritique [7,8,9,10]. Les ions plomb sont libérés dans l'environnement en général par les industries d'extraction de métaux des batteries au plomb acide, du papier, du verre et des industries de polissage. Le cadmium se trouve généralement dans l'eau rejetée lors de la conception de la galvanoplastie des batteries, des cellules photovoltaïques, des processus de métallurgie et des usines de fabrication de tissus [11]. Les ions nickel peuvent provoquer des maladies de la peau lorsqu'ils entrent en contact avec des bijoux, des fermetures éclair, des montres, des pièces de monnaie, etc. Les ions chrome-métal (VI) provoquent des maladies telles que des lésions hépatiques, une néphrite et des maux d'estomac, et les ions Cr (VI) sont également la principale cause de ulcère de la muqueuse nasale [12]. La figure 1 montre l'adsorption des ions de métaux lourds sur le nanomatériau de carbone (graphène), et la figure 2 met en évidence les différentes sources de contamination par les métaux lourds dans l'environnement. En raison de ces effets indésirables graves, l'élimination des ions de métaux lourds de l'eau est d'une importance primordiale pour sauver des vies humaines de ces problèmes de santé problématiques. Les ions métalliques toxiques pourraient être éliminés par de nombreuses méthodes, telles que l'échange d'ions, l'osmose inverse, la filtration par précipitation, la biosorption, la coagulation et l'extraction [13, 14]. L'adsorption est considérée comme la meilleure méthode car elle est rentable, très efficace et facile à utiliser pour éliminer les traces d'ions de métaux lourds [15]. Différents matériaux ont été appliqués pour le traitement de l'eau tels que les adsorbants végétaux et les matériaux de nature organique, en particulier l'acide humique qui a été largement appliqué pour la désinfection de l'eau et pour l'élimination des ions de métaux lourds [8, 16, 17, 18, 19]. Wang et al. ont passé en revue de manière approfondie l'acide humique et son nanocomposite dans le traitement de l'eau [20].
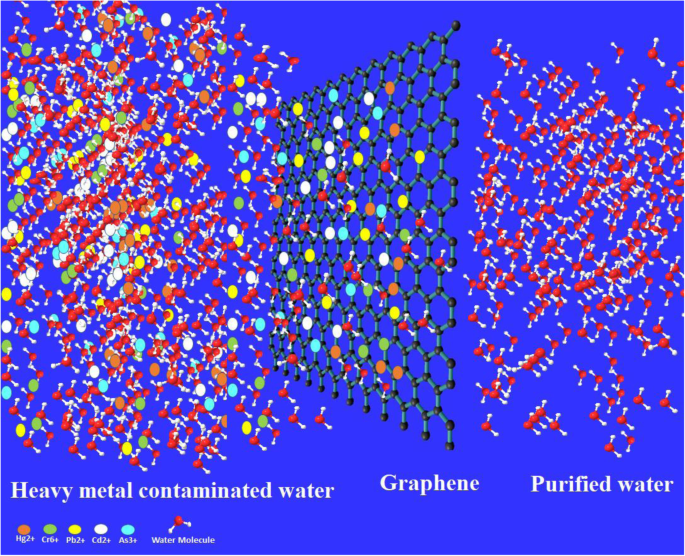
Résumé graphique montrant que le processus de purification de l'eau contaminée par des métaux lourds utilisant du graphène et d'autres matériaux à base de carbone peut également faire la même chose
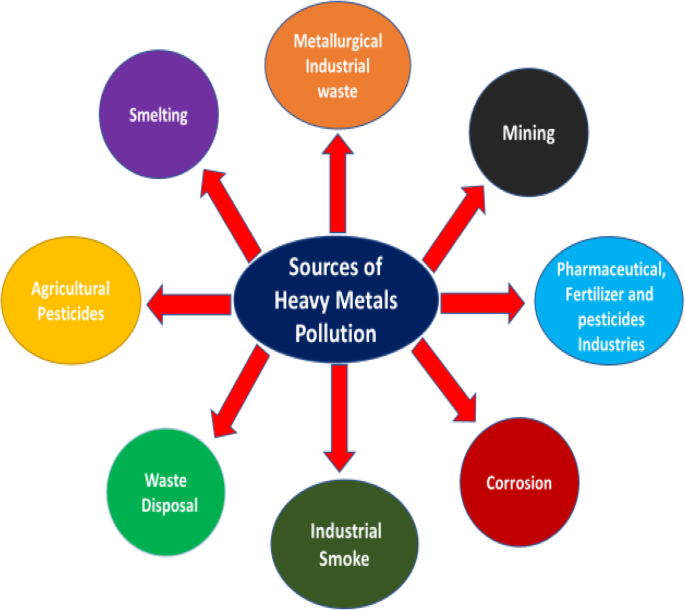
Sources de contamination par les métaux lourds dans l'environnement
La plate-forme de nanotechnologie trouve des applications dans presque tous les domaines tels que les sciences de l'environnement, les sciences de la santé, l'électronique, la séparation industrielle, les usines portables de traitement de l'eau à grande/petite échelle, les catalyseurs, le stockage d'énergie et la production d'énergie [21,22,23]. Les nanomatériaux fournissent une plate-forme spéciale pour la purification de l'eau contaminée en raison de la grande surface spécifique des nanosorbants et de leur capacité de modification chimique et de régénération plus facile. Les nanomatériaux sont de plus en plus exploités pour éliminer différents types de polluants, à savoir les substances organiques, les ions métalliques, les contaminants biologiques et l'arsenic de l'eau [24,25,26,27]. Les nanomatériaux de carbone, à savoir le graphène, l'oxyde de graphène, les nanotubes de carbone, les fullerènes et les charbons actifs, ont été largement utilisés dans le stockage d'énergie, les capteurs, l'électronique, la purification de l'eau, l'administration de médicaments, le diagnostic de maladies, etc. en raison de leurs propriétés chimiques, mécaniques, thermiques et Caractéristiques électriques. Dans cet article, nous avons essayé de passer en revue les dernières avancées dans l'application des nanomatériaux de carbone, à savoir les fullerènes, les nanotubes de carbone (CNT), le graphène, l'oxyde de graphène et le charbon actif dans la purification de l'eau contaminée par des ions de métaux lourds.
Santé humaine et toxicité des métaux lourds
Les métaux lourds sont généralement définis en fonction de leur poids atomique; cependant, le terme métaux lourds fait également référence à des éléments toxiques pour les êtres vivants [28]. Certains métaux lourds sont mortels pour la santé humaine et d'autres êtres vivants sous leurs différentes formes et doses (tableau 1). Fréquemment, les métaux lourds sont considérés comme toxiques; cependant, des métaux plus légers peuvent également être mortels, par exemple le béryllium et le lithium. Tous les métaux lourds ne sont pas toxiques pour la santé, car certains sont fondamentaux, par exemple le fer et le Cr (III). Les métaux toxiques les plus connus sont le Pb, le Cd, le Cr, le Mn, le Hg, l'As et les métaux radioactifs. Les métaux radioactifs ont une toxicité à la fois radiologique et chimique. La toxicité des métaux lourds s'est avérée être une menace majeure, et de nombreux risques pour la santé y sont associés. L'impact mortel de ces métaux est le fait qu'ils n'ont aucun rôle biologique; cependant, ils peuvent imiter en tant qu'élément du corps et interférer avec les processus métaboliques et autres processus biologiques. Certains métaux comme l'aluminium peuvent être facilement éliminés par le système d'excrétion, tandis que certains métaux s'accumulent dans la chaîne alimentaire et dans l'organisme. La toxicité induite par les métaux dépend de la dose, de la voie d'exposition et du temps de contact (par exemple, aigu ou chronique). Les détails de la toxicité associée aux différents métaux lourds sont donnés ci-dessous.
Toxicité du mercure (Hg)
Le mercure (Hg) est un élément du bloc d avec un numéro atomique 80 et est sous forme liquide dans des conditions standard. Le mercure se trouve dans des gisements de sulfure mercurique appelés cinabre. La pollution au mercure est causée par les industries pharmaceutiques, la conservation des pâtes et papiers, l'industrie de la production de soude caustique, l'industrie agricole, etc. [47]. Le mercure est le métal lourd le plus toxique dans l'environnement, et l'empoisonnement au mercure est appelé maladie rose, également connue sous le nom d'acrodynie. Le mercure peut se combiner avec des composés organiques et inorganiques. Des niveaux d'exposition élevés au mercure sous quelque forme que ce soit peuvent endommager les reins, le cerveau, le fœtus en développement, etc. [48]. L'agence de protection de l'environnement a déclaré le méthylmercure et le chlorure mercurique cancérigènes. L'exposition au mercure peut également causer des lésions pulmonaires, des éruptions cutanées, des problèmes de mémoire et une perte de cheveux. L'Organisation mondiale de la santé (OMS) a fixé la norme pour l'eau potable avec des niveaux inférieurs de mercure à 0,01 mg/l [29].
Toxicité du plomb (Pb)
Le plomb (Pb) est un élément de numéro atomique 82 et est considéré comme un métal lourd d'aspect bleu argenté qui vire au gris terne sous l'action de l'air [30]. Il existe diverses sources de pollution au plomb, principalement les déchets des industries des batteries, les engrais et les pesticides, les opérations de placage et de finition des métaux, les gaz d'échappement, les additifs dans l'essence, les pigments dans les automobiles et la fonte des minerais. Ce métal toxique lourd devient une préoccupation environnementale et sanitaire dans le monde entier en raison de son utilisation généralisée [31]. Le plomb (Pb) est un élément cancérigène déclaré par l'Environmental Protection Agency (EPA). L'empoisonnement au plomb est un terme utilisé pour sa toxicité, et il peut être aigu ou chronique. L'empoisonnement au plomb peut provoquer un retard mental, des malformations congénitales comme l'autisme, des allergies, la dyslexie, la paralysie, des lésions cérébrales et rénales et peut également entraîner la mort [32].
Toxicité de l'arsenic (As)
L'arsenic est un élément métalloïde ayant un numéro atomique de 33 et se présente sous forme minérale généralement en combinaison avec du soufre, d'autres métaux, des sels de fer, de calcium, de sodium et de cuivre, ainsi que sous forme élémentaire pure [33]. L'eau est contaminée par des pesticides à base d'arsenic, des dépôts de minéraux naturels et une élimination inappropriée de réactifs ou de produits chimiques à base d'arsenic. L'arsenic sous forme d'arséniate et d'arsénite est mortel pour l'environnement et les êtres vivants. L'arsenic perturbe le protoplasme des cellules en interagissant avec le groupe sulfhydryle des cellules provoquant un dysfonctionnement de la respiration et affectant la mitose et les enzymes cellulaires [34].
Toxicité du Cadmium (Cd)
Le cadmium a un numéro atomique de 48 et est un métal mou blanc bleuâtre ayant des propriétés chimiques similaires au mercure et au zinc du groupe 12 [30]. Ils sont produits à partir de la fusion de ses minerais, de la galvanoplastie, des batteries, des plastifiants, des alliages, des pigments, de l'industrie nucléaire et de la fumée de cigarette. En général, le cadmium est présent à de faibles concentrations dans l'environnement; cependant, les déchets industriels ont considérablement augmenté ces niveaux. La toxicité induite par le cadmium peut endommager les reins, les systèmes respiratoires et le squelette et est cancérigène pour l'homme [30, 33]. Le cadmium est classé septième métal le plus toxique par l'Agence pour le registre des substances toxiques et des maladies (ATSDR) [34].
Toxicité du chrome (Cr)
Le chrome (Cr) est un élément de numéro atomique 24, d'aspect gris acier [35]. Le chrome se produit dans différents états, par exemple, les états divalent, tétravalent, pentavalent et hexavalent ; cependant, les formes trivalentes et hexavalentes sont les plus stables. Le chrome (III) est un complément nutritionnel essentiel pour l'homme et l'animal [35]. Cependant, la forme chrome (VI) est de nature hautement toxique et cancérigène [36, 37]. Le chrome est produit dans des matrices environnementales (air, eau et sol) à partir de différentes sources, par exemple, les eaux usées et l'air principalement rejetés par les industries métallurgiques et chimiques. Le chrome hexavalent Cr (VI) est un polluant industriel reconnu cancérogène pour l'homme [38, 39]. La concentration de Cr (VI) dans les eaux souterraines et les eaux de surface est dépassée et l'Organisation mondiale de la santé (OMS) a fixé la limite de 50 μg par litre [40].
Toxicité du zinc (Zn)
Le zinc (Zn) est un élément ayant un numéro atomique 30 et placé dans le groupe 2 du tableau périodique. Bien que le zinc soit un métal trace essentiel pour l'homme, une absorption excessive de zinc peut supprimer l'absorption du fer. Les ions zinc sont hautement toxiques pour les plantes, les poissons vertébrés, les invertébrés, etc. [41,42,43].
Classification des nanomatériaux de carbone en fonction de leurs dimensions
Les nanomatériaux dont les trois dimensions sont inférieures à 100 nm sont appelés nanomatériaux à zéro dimension (0-D) ; des exemples sont le fullerène et les points quantiques [44]. Les nanomatériaux ayant une seule dimension supérieure à 100 nm et deux dimensions inférieures à 100 nm sont appelés nanomatériaux unidimensionnels (1-D), par exemple des nanotubes de carbone et de titane [45, 46]. Les nanomatériaux dont les deux dimensions sont supérieures à 100 nm sont appelés nanomatériaux bidimensionnels, un exemple célèbre est le graphène. Les matériaux tridimensionnels dont toutes les dimensions sont supérieures à 100 nm sont appelés matériaux tridimensionnels (3-D) ; des exemples sont le graphite et certains composites de nanomatériaux [46]. La figure 3 montre certains matériaux carbonés de structure célèbres représentatifs avec différentes dimensions, par exemple, le fullerène 0-D, le nanotube de carbone à paroi unique 1-D, le graphène 2-D et le graphite 3-D.
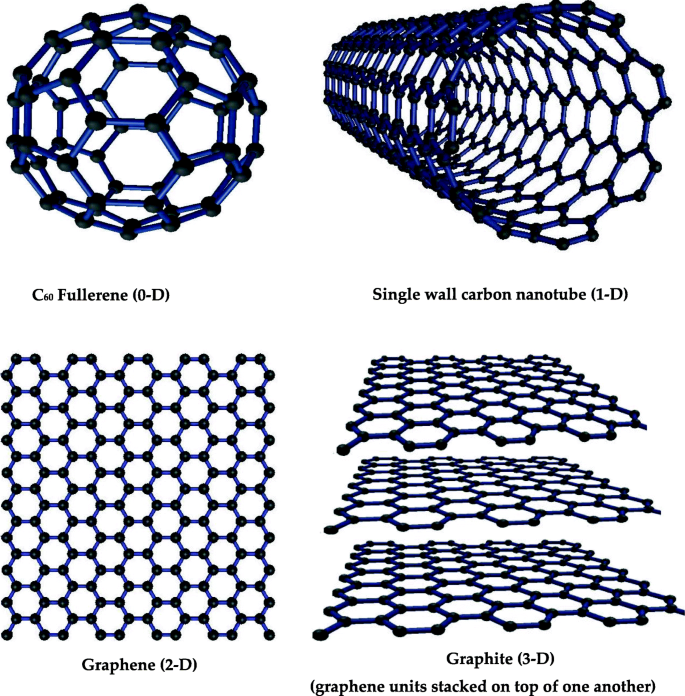
Les exemples de nanomatériau de carbone de différentes dimensions
Application des fullerènes dans l'assainissement de l'environnement et la purification de l'eau
Les fullerènes ont été découverts en 1985 dans la poussière interstellaire, et ils ont une structure annulaire pentagonale et hexagonale en cage fermée, représentée par la formule C20 + m où m est un entier [49]. Ils ont un caractère hydrophobe, une affinité électronique élevée et un rapport surface/volume élevé, ainsi que des défauts de surface. Ces propriétés physico-chimiques uniques en font un matériau idéal pour diverses applications telles que les semi-conducteurs, l'électronique, les sciences biomédicales, les cellules solaires, les capteurs, les cosmétiques, la photosynthèse artificielle et les revêtements de surface [50,51,52]. Brunet et al. ont montré que les fullerènes fonctionnalisés hydrophiles (C60 ) ont également été appliqués pour tuer les micro-organismes pathogènes dans l'eau en utilisant un procédé photocatalytique. Les fullerènes sont également des matériaux verts propres idéaux pour le stockage de l'hydrogène, car les molécules de fullerène peuvent facilement être converties en liaisons C-C en C-H en raison des énergies de liaison plus faibles du carbone et de l'hydrogène [27]. Il a été rapporté que les fullerènes ont le stockage maximal de 6,1% d'hydrogène en raison de leur chimie et de leur structure moléculaire en cage, et la structure des fullerènes peut facilement être inversée en raison des énergies de liaison C-C plus élevées [3, 53, 54]. Des couches conductrices de carbone sont appliquées sur la surface des électrodes des supercondensateurs et leur capacité dépend de la surface, de la distribution de la taille des pores et de la conductivité électrique [55, 56]. Les nanomatériaux à base de carbone offrent une conductivité électrique plus élevée que les matériaux disponibles orthodoxes en raison de la plus grande surface spécifique [57]. Il a été rapporté que les matériaux composites à base de fullerène présentent une capacité spécifique plus élevée de 135,36 Fg − 1 que le matériau de graphène pur qui n'a pas été hybridé avec le fullerène. En plus de cela, le composite à base de fullerène présentait un meilleur taux de temps de rétention de 92,35 % même après un cercle de charge/décharge de 1000 [58]. Les fullerènes ont également été utilisés dans les batteries lithium-ion comme anode et offrent une meilleure efficacité avec le remplacement des anodes métalliques non dégradables, s'avérant ainsi bénéfiques en termes d'efficacité et de matériau respectueux de l'environnement. Les propriétés physico-chimiques des fullerènes en font également des candidats appropriés pour l'extraction de différentes espèces des milieux aqueux [59, 60]. Pickering et al. ont conçu des composés de fullerène solubles dans l'eau et les ont appliqués avec succès comme sensibilisateurs pour produire des espèces réactives de l'oxygène (ROS) dans l'eau lors de l'irradiation de rayonnements visibles et ultraviolets. Les ROS peuvent photodégrader les contaminants organiques dans l'eau, et en plus de cela, les fullerènes solubles dans l'eau (fullerols) agissent également comme antioxydants. Plus important encore, les fullerols peuvent être facilement éliminés de l'eau après avoir effectué la fonction de photodégradation [53].
On pense que les fullerènes ont adsorbé les espèces par la pénétration d'adsorbats dans les espaces/défauts entre les nanoclusters de carbone, et en plus des défauts, une tendance à l'agrégation plus faible et une grande surface en font des nanomatériaux utiles à appliquer pour l'adsorption d'ions de métaux lourds provenant de eau [61, 62]. Alekseeva et al. mené des études comparatives de fullerène et de film nanocomposite-polystyrène pour l'élimination du Cu 2+ ions; ils ont trouvé que les fullerènes montraient une meilleure efficacité [60]. Ils ont également découvert que les fullerènes suivent le modèle d'adsorption de Langmuir pour Cu 2+ ions [60]. Ils ont établi que le Cu 2+ l'efficacité d'élimination des fullerènes est plus élevée dans le premier cas, et l'isotherme d'équilibre du Cu 2+ l'adsorption sur le fullerène correspond au modèle de Langmuir. Bien que les fullerènes aient un grand potentiel pour l'application d'adsorption d'eau, leur coût est trop élevé, ce qui restreint leur utilisation. Cependant, les traces de fullerènes peuvent être utilisées pour fabriquer d'autres matériaux comme le charbon actif, la lignine et les zéolites pour augmenter leur efficacité d'adsorption [63]. La fabrication du fullerène augmente le caractère hydrophobe qui rend les matériaux mieux adaptés à l'adsorption et contribue également à un recyclage plus facile [64]. Il a été rapporté qu'un matériau antibactérien est formé par greffage de fullerène C60 avec de la polyvinylpyrrolidone (PVP) qui a le potentiel d'être appliqué dans la désinfection de l'eau. La technologie membranaire attire de plus en plus l'attention dans la purification des sels, des matières organiques, des particules et des gaz de l'eau. La performance de la membrane dépend de la composition du matériau car elle est responsable de la réactivité, de la sélectivité et de la résistance mécanique. Les fullerènes ont un fort potentiel pour être appliqués dans la technologie des membranes en raison de leur facilité de fonctionnalisation, de leur affinité électronique élevée, de leur grande résistance, de leur capacité à adapter la taille, etc. Les fullerènes peuvent être utiles pour greffer les nano-adsorbants afin d'améliorer leur efficacité d'adsorption.
Biocompatibilité des Fullerènes
Les nanomatériaux à base de fullerène ont été exploités pour des applications biomédicales, et différentes études ont révélé leur biocompatibilité avec les organismes vivants. Il a été utilisé comme biorécepteur ainsi que comme biocapteur et également exploité en génie biomédical, et il a été rapporté qu'il est biocompatible avec les systèmes vivants [65,66,67,68,69]. Le fullerène est un matériau non toxique qui peut être exploité pour la filtration, les adsorbants et les membranes pour les applications de traitement de l'environnement et de l'eau.
Nanotubes de carbone (CNT)
Les nanotubes de carbone ont été découverts par Lijima en 1999 et ils peuvent être à paroi unique (SWCNT), par exemple, du graphène enroulé en couches, ou des nanotubes de carbone à plusieurs parois (MWCNT), par exemple, du graphène enroulé multicouche [70]. Les NTC ont été au centre de la recherche en nanotechnologie depuis leur découverte en raison de leurs propriétés physico-chimiques uniques. Ces allotropes de nanostructure cylindrique de carbone sont appliqués dans l'électronique, les semi-conducteurs, l'émission de champ, le stockage d'énergie, la catalyse, le biomédical, les filtres à air et à eau, etc. Leur diamètre peut aller de 1 nm à plusieurs nanomètres avec une grande surface spécifique (150– 1500 m 2 /g), et ils possèdent des mésopores qui en font le candidat idéal pour l'élimination des ions de métaux lourds par adsorption [71, 72]. En plus de cela, les NTC peuvent être facilement fonctionnalisés avec diverses molécules organiques qui peuvent les rendre spécifiques pour la sélection des adsorbats et leur capacité d'adsorption pourrait être améliorée [73]. Le mécanisme de sorption des métaux lourds par les NTC repose sur la caractéristique de surface, le potentiel électrochimique et le processus d'échange d'ions [11, 73].
Application environnementale des NTC/technologie verte basée sur les NTC
Il y a une immense augmentation de la demande énergétique mondiale et de nombreux efforts sont déployés pour développer un matériau simple, économique et respectueux de l'environnement pour des technologies fiables pour les matériaux de ressources énergétiques. L'énergie solaire est produite par conversion électrique solaire et conversion solaire thermique [74]. Cependant, le faible rendement de la conversion thermique dans les capteurs solaires est le principal obstacle.
Les nanofluides de carbone sont largement appliqués dans la conversion thermique solaire en raison de leurs bonnes performances en tant qu'absorbeurs solaires [75]. Les cellules photovoltaïques à base de nanotubes de carbone (PVC) ont beaucoup retenu l'attention des scientifiques car elles peuvent être des semi-conducteurs de type p avec une excellente mobilité et leur combinaison avec des donneurs d'électrons est une idée nouvelle et unique [76, 77]. Les dispositifs photovoltaïques organiques peuvent être facilement conçus par la fabrication de NTC avec des polymères [78]. Des cellules solaires à hétérojonction CNT -Si (p-n) ont été conçues pour produire d'excellents films conducteurs et transparents. En plus de cela, des NTC avec de l'arséniure de gallium de type n (n-GaAs) ont également été rapportés avec une meilleure efficacité de 3,8% pour le laser vert et la lampe de bureau [79]. Les NTC ont également été des dispositifs de stockage d'énergie largement exploités fonctionnant sur les principes des condensateurs électrochimiques à double couche (EDLC) comme les ultracondensateurs [80]. L'incorporation de NTC dans les électrodes des ultracondensateurs a permis d'améliorer considérablement la durée de vie avec plus de 300 000 cycles [81]. En plus de cela, les super condensateurs CNT ont également été utilisés dans les diodes au lieu des transistors conventionnels car ils peuvent faire des jonctions p-n parfaites en raison de leurs excellentes propriétés mécaniques et électriques [58]. Les NTC ont également été largement utilisés dans la technologie des capteurs avancés car ils peuvent améliorer la sensibilité, la sélectivité, le temps de réponse, la rentabilité et la durée de vie des produits chimiques et des biocapteurs [90]. Ces résultats suggèrent que de meilleurs NTC sont des matériaux idéaux avec une excellente mobilité et une meilleure efficacité sans impact négatif sur l'environnement, ce qui est un inconvénient majeur avec les matériaux de type p à base métallique les plus couramment appliqués.
Application des NTC en photocatalyse
La photocatalyse est l'une des technologies avancées appliquées pour le traitement des eaux usées qui utilise des semi-conducteurs [82]. Une variété de matériaux semi-conducteurs est appliquée, à savoir Fe3 O4 , ZnO et TiO2; cependant, l'efficacité quantique de ces matériaux n'est pas élevée, et en plus de cela, leur réponse photo ultraviolette est également lente [83]. Les NTC sont des matériaux avancés prometteurs pour la catalyse en raison de leur efficacité quantique améliorée, de leur taille nanométrique, de leur stabilité chimique élevée, de leur structure en tube creux et de leur région d'adsorption de lumière étendue en raison de leur grande surface spécifique [84]. Gao et al. SWCNTs-TiO2 conçus à base de photocatalyseurs à réseau ultrafin et appliqué avec succès pour la purification de l'eau à partir du pétrole [85]. Parc et al. oxyde de titane décoré sur aérogel de SWCNTs et appliqué avec succès pour l'élimination du bleu de méthylène de l'eau [86]. Zhao et al. MWCNTs-TiO2 fabriqués et appliqué pour la photodégradation du bleu de méthylène [87]. Xu et al. photocatalyseurs conçus par la combinaison d'hydroxy-MWCNTs et de PbO2 anode nanocristalline et l'a appliquée avec succès pour l'élimination de la pyridine de l'eau [88].
SWCNT dans la purification de l'eau contaminée par des métaux lourds
Les SWCNT sont des nanomatériaux de carbone unidimensionnels (1-D) constitués d'un tube creux dont les parois ont une épaisseur d'un atome. Ce matériau 1-D présente des propriétés physico-chimiques exceptionnelles en raison de sa structure unique. Les SWCNT sont largement appliqués dans différents domaines tels que les semi-conducteurs, l'électronique, les sciences biomédicales, la chimie et les biocapteurs [44, 89, 90, 91, 92, 93]. Les SWCNT sont également largement utilisés pour le contrôle de la pollution environnementale en raison de leur structure poreuse, de leur surface spécifique élevée, de leur fonctionnalisation de surface plus facile et de leur taille nanométrique. Ces propriétés des SWCNT sont très prometteuses pour leur application dans le traitement de l'eau. Alijani et al. conçu des nanocomposites à base de SWCNT en les fabriquant avec du sulfure de cobalt de magnétite, et les nanocomposites résultants ont été appliqués pour l'élimination du mercure ; les résultats ont montré une adsorption élevée de plus de 99,56 % sur une période plus courte de 7 min [94]. En comparaison, les SWCNT seuls se sont avérés adsorber 45,39 % de mercure [94]. Anita et al. a mené une simulation de dynamique moléculaire de SWCNT nus et de leurs homologues fonctionnalisés, par exemple, SWCNTs-OH, SWCNTs-NH2 , et SWCNTs-COOH pour les capacités d'adsorption des ions de métaux lourds, par exemple, Cd 2+ , Cu 2+ , Pb 2+ , et Hg 2+ à partir de milieux aqueux. Les résultats ont révélé que les SWCNT-COOH ont des capacités d'adsorption supérieures d'environ 150 à 230 % par rapport aux SWCNT nus. Les SWCNTs-OH et les SWCNTs-NH se sont avérés faibles en adsorption car ils montraient juste une adsorption 10 à 47% plus élevée que les SWCNTs [95]. Des SWCNTs-COOH ont également été rapportés pour l'adsorption de Pb 2+ , Cu 2+ , et Cd 2+ ions avec une capacité d'adsorption de 96,02, 77,00 et 55,89 mg/g, respectivement. En comparaison, les SWCNT non fonctionnalisés adsorbent 33,55, 24,29 et 24,07 mg/g, pour le Pb 2+, Cu 2+ , et Cd 2+ respectivement [96]. Zazouli et al. conçu des nanocomposites SWCNT en les fonctionnalisant avec de la l-cystéine. Ils ont appliqué les nanocomposites conçus pour l'élimination du mercure de l'eau. L'efficacité d'adsorption des SWCNTs-cystéine conçus s'est avérée être de 95 % [97]. Gupta et al. conçu une membrane à base de nanocomposite SWCNTs-polysulfone et appliqué pour l'élimination des métaux lourds. L'incorporation de SWCNT a entraîné une réduction de la taille des pores de la membrane et une surface plus lisse. La membrane conçue s'est avérée montrer une capacité de rejet élevée pour les ions métalliques et a éliminé 96,8 % de Cr + 6 , 87,6% As + 3 , et 94,2 % Pb + 2 ions. La membrane sans SWCNT n'a montré que 30,3 %, 28,5 % et 28,3 % de rejet pour Cr + 6 , As + 3 , et Pb + 2 ions respectivement. Ces résultats montrent l'amélioration de l'efficacité de la membrane due à l'incorporation de SWCNTs [98]. Dehghani et al. SWCNT appliqué pour l'élimination de Cr + 6 ions de l'eau et évalué l'effet de différents paramètres, par exemple, le temps de contact, le pH initial et le Cr + 6 initial concentration ionique sur la capacité d'adsorption. Il a été observé que l'efficacité d'adsorption dépendait du pH, une efficacité maximale a été trouvée à pH 2,5 et l'adsorption suit le modèle isotherme de Langmuir [99]. Ces études suggèrent que les nanotubes de carbone à paroi unique conviennent au traitement de l'eau contaminée par des métaux lourds.
MWCNT dans la purification de l'eau contaminée par des métaux lourds
Les nanotubes de carbone ayant plusieurs couches laminées de graphène sont appelés nanotubes de carbone multiparois (MWCNT), comme le montre la figure 4. Les MWCNT présentent des propriétés uniques telles qu'une surface élevée, une conductivité électrique et thermique élevée et une résistance à la traction élevée [100]. En raison de ces propriétés physico-chimiques, ils sont largement appliqués dans l'électronique, les cellules solaires, les capteurs et les sciences biomédicales [101,102,103]. Les MWCNT ont également été largement appliqués dans le traitement de l'eau, et en particulier les ions de métaux lourds sont adsorbés par interaction chimique avec les groupes fonctionnels des MWCNT. Il a été rapporté que les MWCNT oxydés ont une capacité d'adsorption et une efficacité élevées pour le Cr 6+ , Pb 2+ , et Cd 2+ ions de l'eau [104, 105]. L'adsorption des ions métalliques dépend également de la valeur du pH, et cette propriété peut être appliquée pour la désorption des ions en modifiant le pH, et les MWCNT peuvent être réutilisés. Certaines études ont révélé que les MWCNT oxydés par plasma ont de meilleures propriétés d'adsorption que ceux oxydés chimiquement; ceci peut être attribué à un nombre plus élevé de groupes fonctionnels oxygénés présents à la surface des nanotubes de carbone. De plus, il a été rapporté que les MWCNT oxydés au plasma peuvent être facilement recyclés et réutilisés [72, 106].
Structure en nanotubes de carbone multiparois (MWCNT)
Le matériau composite des MWCNT a également été utilisé pour l'adsorption des ions de métaux lourds de l'eau. Les MWCNT-Fe2 O3 , MWCNTs-ZrO2 , MWCNTs-Fe3 O4 , MWCNTs-Al2 O3 , et MWCNTs-MnO2 -Fe2 O3 les nanocomposites ont été appliqués avec succès pour l'élimination des ions lourds de Cr 6+ , As 3+ , Ni 2+ , Pb 2+ , et Cu 2+ ions de l'eau [107,108,109,110]. Les conditions expérimentales des solutions, y compris le pH et les concentrations d'ions métalliques, peuvent affecter les caractéristiques d'adsorption des MWCNT, et le modèle d'adsorption de Freundlich satisfait de leurs données expérimentales [81, 111]. L'efficacité d'adsorption des MWCNT fonctionnalisés a augmenté par rapport à d'autres matériaux d'oxydes organiques, et il est également prédit que les MWCNT fonctionnalisés sont 20 fois plus efficaces dans l'adsorption des ions métalliques que les MWCNT non oxydés [112]. On pense généralement que les liens des ions et l'occurrence de la surface polaire des nanotubes de carbone sont le principal mécanisme de sorption, [113, 114]. Les MWCNT oxydés ont également montré une capacité de sorption et une efficacité exceptionnellement élevées pour Pb 2+ , Cd 2+ , et Cr 6+ de l'eau. The sorption efficacy of MWCNTs with acid treatment increases the potential to remove lead, chromium, and cadmium ions with oxygen functional group making the complexes of ions or precipitates of salts on the surfaces [115]. Adsorption of MWCNTs treated with concentrated HNO3 increases significantly mainly due to oxygen functional groups created on the surface of acidified nanotubes that can react with metal ions to form complex or salt precipitates on the surface. The MWCNT composites with certain compounds like iron (III) oxide, zinc oxide, and aluminum oxide are formed by a coprecipitation method, and resulting composites are successfully applied for the removal of chromium, nickel, lead, copper, and arsenic ions. The adsorption efficiency of these nanocomposites was found to be dependent on the pH value and temperature, and the sorption process can be accomplished by changing these parameters [116, 117]. Depending on the pH and temperature, the sorption capacity of these composites varied from 10 to 31 mg/g. The adsorption process for these nanocomposites was well described by the Langmuir model [118]. The nanocomposites of oxidized multiwalled MWCNTs with manganese oxide/iron (III) oxide are reported to remove Cr 6+ ions with maximum adsorption capacity of 186.9 mg/g with the maximum removal capacity of 85% at the optimum pH 2.1 studies. Their promising adsorption was due to the surface polarity of the adsorbents. It has also been reported that plasma-oxidized MWCNTs are better in adsorption compared to chemically oxidized ones as the prior ones have more oxygenated functional groups [119]. Plasma-oxidized technique has also been reported for the formation of nanotubes with titanium oxide and manganese dioxide and utilized for the removal of lead ions from water. The results showed that these hybrid systems can act as an effective adsorbent for the lead ions in the first case; the adsorption capacity was 137 mg/g, and in the second case, it was 78.74 mg/g [120]. In a heterogeneity adsorbent surface, sites combined twice are fitted in the isotherms models of the Langmuir-Freundlich equation that was used to differentiate between two types of adsorption sites with greater and lesser energy affinities for the Ni 2+ ions [121]. It is believed that nickel ion sorption mainly occurs at the sites of energy with modified nanocomposites of MWCNTs and the nano-modification leads to a 20% increase in the adsorption capacity at small (up to 0.1 mol/l) equilibrium adsorbate concentrations. Another modification reported for MWCNTs is their functionalization with hydroxyquinoline and their application for the removal of copper, lead, cadmium, and other toxic ions [122]. The carbon nanotubes alone as well as in their oxidized and in their composite forms have tremendous ability to adsorb the heavy metal ions, and a lot of research is in progress for their applications in purification of water. Elsehly et al. applied commercial MWCNTs for the removal of the manganese and iron which could reach 71.5% and 52% respectively with a concentration in aqueous solution of 50 ppm of these metal ions [123]. In another study, CNT-based nanocomposites have been applied for the removal iron and manganese from the water [124].
Biocompatibility of CNTs
Carbon nanotubes have great potential to be applied for multidisciplinary fields like drug delivery, diagnosis, biosensors, electronics, semiconductors, and environmental remediations [125]. Different studies revealed the biocompatibility of CNTs as it has been widely exploited for biomedical applications [126, 127]. Carbon-based materials like CNTs are safe to be applied for the environmental remediation and in particularly for water treatment.
Graphene Based Material for Environmental Remediation
Graphene-based material for the adsorption of gaseous contaminants
Carbon dioxide (CO2 ) has been the environmental concern because of its immense effect in global warming [128]. Nanomaterials have been found to be promising materials as compared to conventional materials both with respect to cost and efficiency [129]. Graphene-based materials have been utilized for the adsorption of gaseous contaminants [130]. Gosh et al. showed the successful application of graphene-based nanomaterials for the capture of CO2 et H2 . A single layer of graphene has been reported to capture 37.93% of CO2 [130]. Graphene has been reported to selectively adsorb CO2 as compared to methane (CH4 ) and nitrogen (N2 ) gases. Selectivity of graphene oxide (GO) for CO2 can be attributed to higher dipole moment of carbon dioxide which can easily interact with polar oxygenated functional groups of CO2 [74, 131]. Other studies have also been reported for tuning the graphene chemistry for the improved selectivity of the desired gaseous contaminant [75, 131].
Graphene Oxide in Removal of Organic Dyes from Water
Graphene-based nano-adsorbents are excellent advanced materials for the removal of the organic contaminants from the water because of their nano-scaled size, high surface area, ability to interact via pi-pi stacking, hydrogen bonding, and electrostatic interactions [26]. In comparative adsorption studies of GO and graphite using methylene blue and malachite green as standard organic dyes, it was found that GO showed much better adsorption than graphite [26]. GO has also been utilized for the removal of cationic dyes namely methylene blue (MB), crystal violet (CV), and rhodamine B (RhB) from water. It was found that the higher the initial dye concentration, the higher will be the adsorption with adsorption capacities of 199.2, 195.4, and 154.8 mg g −1 for MB, CV, and RhB, respectively [76]. GO has also successfully applied for the removal of anionic dyes like Acid Orange 8 (AO8) and Direct Red 23 (DR23) from aqueous solutions [77].
Graphene-Based Photocatalytic Materials for Water Decontamination
Although adsorption can remove the contaminant from water, the adsorption technique is unable to destroy/degrade the contaminants and disposal step is required [77]. Photocatalysis is a useful approach for water remediation/wastewater treatment for the complete degradation and mineralization of organic/biological contaminants [78]. Graphene-based photocatalysts have been reported for their improved activity because of their high surface area, nanosize, and more electronic movements as compared to the traditionally used materials [78, 132]. Rommozzi et al. designed reduced graphene oxide (rGO) with a greener reduction method using glucose and ammonium hydroxide and successfully designed a photocatalyst which is visible by the fabrication with TiO2 . The designed rGO-TiO2 photocatalyst was successfully applied for the refractory dye named Alizarin Red S (ARS) [133]. In other studies, graphene oxide fabricated with TiO2 and ZnO exhibited much photodegradation of methylene blue as compared to TiO2 /ZnO alone [79, 80].
Graphene and Graphene Oxide-Based Adsorbents for the Purification of Heavy Metal-Contaminated Water
Graphene is one-atom-thick-layered hexagonal lattice of carbon atoms and is known as the thinnest material with the strength of 200 times than steel. Graphene was discovered in 2004 by Sir Andre Geim and Sir Konstantin Novoselov, who were awarded a Nobel prize for their discovery in 2010. Graphene (2-D) is being used widely in almost every field such as in touch screens, mobiles, LCDs, semiconductors, computer chips, batteries, energy generation, water filters, supercapacitors, solar cells, and biomedical and environmental sciences [134,135,136,137]. These 2-D graphene-based materials are getting more and more attention in water treatment due to their unique physicochemical characteristics namely electronic properties, high surface area, thermal mobility, high mechanical strength, and tunable surface chemistry [118, 134, 138, 139]. Tabish et al. designed porous graphene and applied it as an adsorbent for the removal of heavy metal ions as well as other pollutants from water. They applied this porous graphene material for As 3+ removal from water and found 80% efficiency. The material was found to retain its water treatment properties after regeneration and recycling [138]. Guo et al. designed a nanocomposite of partially reduced graphene oxide by its fabrication with Fe3 O4 via in situ co-precipitation method and applied it for the removal of Pb 2+ ions from water. The designed nanocomposite was found to be excellent in removing the Pb 2+ ions from aqueous solution with an adsorption capacity of 373.14 mg/g [140]. Zhang et al. functionalized the reduced graphene oxide with 4-sulfophenylazo (rGOs) and applied it for the removal of a variety of heavy metal ions from aqueous solution. The designed material showed the maximum adsorption capacity of 689, 59, 66, 267, and 191 mg/g for the Pb 2+ , Cu 2+ , Ni 2+ , Cd 2+ , and Cr 3+ respectively [141]. Diana et al. designed a graphene-based self-propelled microbot system whose structure was made up of nanosized multilayered consisting of graphene oxide, nickel, and platinum. Each layer performed a different function, e.g., graphene oxide captures the heavy metal Pb 2+ ions, the middle layer of Ni enables the control of microbots with the help of external magnetic field, and the inner layer of platinum helps the engine in self-propelling [142]. The designed system was found to remove the 80% of the Pb 2+ water solution. Figure 5 shows the schematic illustration of the working principle of microbots. Yang et al. designed hydrogen beads using graphene oxide and sodium alginate (GO-SA) and successfully applied them for the removal of Mn 2+ ions from the aqueous solution with excellent adsorption capacity of 56.49 mg/g [9]. Zheng et al. designed nanocomposites by fabrication of zinc oxide with tea polyphenol with reduced graphene oxide (TPG-ZnO). Designed material was applied for the removal of heavy metal ions with an added advantage of antibacterial properties [143]. They applied this material for the removal of Pb 2+ ions from aqueous solution with adsorption efficiency of 98.9%, and the adsorbent was found to possess antibacterial properties against Streptococcus mutans with 99% eradication [143]. Mousavi et al. designed nanocomposites of graphene oxide with iron oxide magnetite nanoparticles Fe3 O4 and applied them for the removal of Pb 2+ ions from water and the material showed 98% removal efficiency with a capacity of 126.6 mg/g [144]. Considering functionalized graphene as an adsorbent to remove Pb 2+ ions from an aqueous medium, the highest record of Pb 2+ ion removal over graphene is 406.6 mg/g at pH of 5.0 in 40 min [145]. Graphene-hydrogel lingo sulfonate functionalized nanocomposites having oxygenated functional groups making the surface highly polar reported to increase the rate of adsorption of Pb 2+ ions with maximum efficacy of 1308 mg/g with the equilibrium reached in 40 min. Awad et al. modified graphene oxide with chloroacetic acid (GO-COOH) and ethylenediamine (GO-amino). The designed systems were applied for the removal of mercury (Hg 2+ ) from water and found that the nanocomposites (GO-COOH) and (GO-amino) have an adsorption capacity of 122 mg/g and 230 mg/g. In addition to this, designed systems retained their adsorption efficiency after the recycling process [146]. Yan et al. designed magnet graphene oxide for the rapid removal and separation of Fe (II) and Mn (II) from micropolluted water [147]. Ali et al. designed graphene-based adsorbent successfully for the removal of noxious pollutants namely Cu (II), Pb (II), Fe (II), and Mn (II) [148].
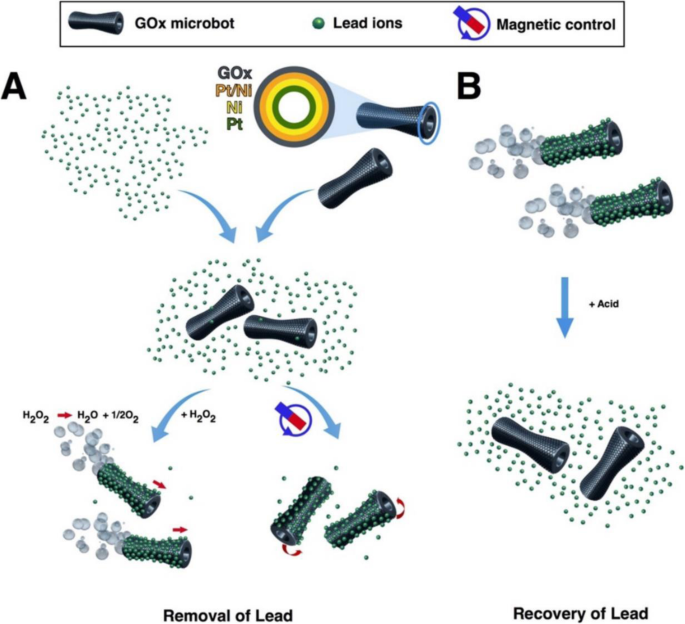
Scheme of GOx-microbot-based approach for lead decontamination and recovery. un Decontamination of polluted water using GOx-microbots fabricated by electrodeposition of nanolayers of graphene oxide (GOx), Pt/Ni layer, Ni magnetic layer, and Pt catalytic inner layer. The decontamination strategy for lead ions can be carried out by two different techniques:self-propulsion of the GOx-microbots in the presence of H2 O2 or by using an external rotating magnetic field. b Recovery of lead ions from the GOx-microbots in the presence of acidic media [117]
Biocompatibility of Graphene-Based Nanomaterial
Graphene-based nanomaterials have been applied in different fields like electronics, chemical sensors, biosensors, drug delivery, theragnostic, and other related biomedical fields. These studies also report the cytocompatibility of graphene-based materials both by in vitro as well as in vivo animal studies [122, 133, 149,150,151,152]. These findings suggest that the graphene-based materials are safe for the environmental remediation application as they are just used for the removal and degradation of pollutants and are not consumed by humans directly.
Activated Carbon in Environmental Remediation
Activated carbon is a fabulous material because of its high surface area, highly porous structure, and ease of preparation with variety of starting materials. Because of its ideal physicochemical properties, it has wide application in environmental remediations in different industries like pharmaceutics, fertilizer plants, petroleum, cosmetics, automobiles, and textiles [153] It is also widely applied for the adsorption of gases, solvent recovery, and wastewater treatment especially for the removal of organic dyes/other pollutants; not only this, but it is also used as a catalyst in biodiesel production. It is also applied as a low-cost material for the treatment and removal of water containing COD, BOD, and TSS and stabilizing and maintaining the optimum pH for biological uses [154,155,156]. Maguana et al. prepared activated carbon from the pear seed cake and successfully applied it for the removal of methylene having an adsorption capacity of 260 mg/g [157]. Antonio et al. prepared activated carbon from the kenaf plant and applied it successfully for the treatment of the wastewater of hospitals containing paracetamol as the main pollutant [158]. The above literature suggests that the activated carbon is the pretty useful economical material which can easily be prepared and it has immense application in environmental remediations.
Activated Carbon as Adsorbents in the Purification of Heavy Metal-Contaminated Water
Activated carbon (AC) is also known as activated charcoal, and this of type carbon material is formed under some treatment protocols resulting in micro/nanopores and having the large surface area of more than 3000 m 2 [159]. The AC is produced on a large scale from coal, wood, and agricultural wastes [160]. In addition to its porous nature (as shown in Fig. 6), AC also has a high mechanical strength which enables its applications in catalyst support, capacitors, electrodes, and gas storage and most importantly used as the adsorbent for removal of metal ions, organic wastes, and gases from water [160,161,162]. The high mechanical strength of activated carbon enables its periodic cleaning, regeneration, and reutilization [160]. Abeer et al. reported the preparation of AC from apricot stone and its application in removal of Zn + 2 and Al + 3 ions with removal efficiency of 92% [163]. Ebrahim et al. designed AC from sewage sludge, applied it for the removal of Cu + 2 ions from water, and found that the designed material showed maximum adsorption capacity of above 50% [164].
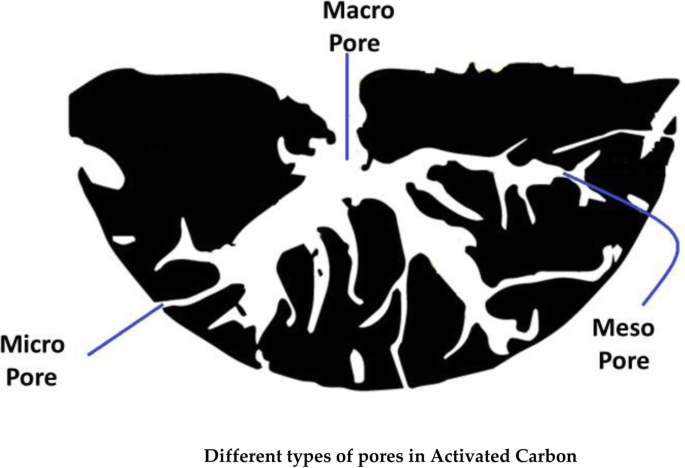
Different types of pores in activated carbon
Li et al. prepared the AC from sewage sludge produced from the wastewater treatment plant and functionalized it with sulfur [165]. They applied sulfonated AC for the removal of Pb 2+ , Cd 2+ , Cu 2+ , and Ni 2+ ions from water. The adsorption capacity of metal ions were found to be 238.1 mg/g, 96.2 mg/g, 87.7 mg/g, and 52.4 mg/g for Pb 2+ , Cd 2+ , Cu 2+ , and Ni 2+ respectively [165]. Cao et al. designed multipore activated carbon (MPAC) with a large surface area using the agricultural waste of long-root Eichhornia crassipes and applied it for removing heavy metal ions, e.g., Pb 2+ , Cd 2+ , Cu 2+ , Ni 2+ , and Zn 2+ . They found that at 30 °C adsorption capacity being 1.34 mmol/g, 1.07 mmol/g, 1.22 mmol/g, 0.97 mmol/g, and 0.93 mmol/g for Pb 2+ , Cd 2+ , Cu 2+ , and Ni 2+ respectively [166]. Dong et al. investigated the application of spent activated carbon (AC) for heavy metal ion removal from water and found high adsorption capacity of 95% and 86% for Pb 2+ and Cd 2+ ions respectively [167]. M. Bali et al. [168] applied commercial AC for the removal of heavy metal ions and found that adsorption equilibrium of Cd 2+ ion took 15 min while for Pb 2+ , Zn 2+ , and Cu 2+ it took 45 min with percentage removal of 64% for all these ions and with Cd 2+ being the highest [10]. Kongsuwan et al. prepared the activated carbon from the agricultural waste of eucalyptus bark. They applied it for the removal of Cu 2+ and Pb 2+ from water with maximum removal capacity of 0.45 and 0.53 mmol per gram of AC respectively, with adsorption being the main mechanism of ion uptake [169]. AC poultry litter has also been reported and applied for the treatment of heavy metal-contaminated water and found that for 1 kg of poultry litter AC adsorbs 404 mmol, 945 mmol, 236 mmol, and 250–300 mmol of Cu 2+ , Pb 2+, Zn 2+ , and Cd 2+ ions respectively [170]. This adsorption is significantly higher than the commercially available AC derived from coconut and bituminous. The AC of wood saw dust of rubber plant has also been reported for the removal of heavy metal ions of Cr + 6 from water with adsorption capacity of 44 mg/g [171]. AC formed from Moso and Ma bamboo was found to be highly efficient in removing the heavy metal ions, i.e., Pb 2+, Cu 2+ , Cr 3+ , and Cd 2+ with the maximum adsorption capacity of more than 90% removal [172]. Naser et al. prepared AC from rice husk and applied them for the removal of Cu 2+ from aqueous solution, and maximum capacity was found to be 33.92%. Similar results have also been reported for the removal of Cu 2+ from the AC formed from Palm shell [173]. AC of love stones has been reported for the adsorption of Cd + 2 and Ni + 2 with adsorption capacity of 1.85 mg/g and 0.67 mg/g respectively in two different studies [174, 175]. AC prepared from olive stone using the microwave method has been applied for the removal of Fe 2+, Pb 2+, Cu 2+, Zn 2+, Ni 2+ , and Cd 2+. from wastewater. Another study reported on the olive stone AC prepared via microwave to remove a group of metal ions from synthetic wastewater:Fe 2+ , Pb 2+ , Cu 2+, Zn 2+ , Ni 2+ , and Cd 2+ with removal efficiency of more than 98% [176]. Tamarind wood AC has been reported for the highest adsorption capacity of above 97% for Pb 2+ from water [177]. Activated carbon has been applied as an adsorbent for the removal of Fe (II) and Mn (II) with great efficiency [178, 179]. The activated carbon is easy to synthesize, is cheaper, and is the most promising material for the adsorption of heavy metal ions and can be prepared at a large scale from a variety of carbon sources especially form agricultural waste. In addition to easier preparation, AC can easily be functionalized. Table 2 summarizes the effect of different parameters on the process of metal ion adsorption.
Biocompatibility of the Activated Carbon
Different studies have been conducted for the biocompatibility evaluation of the activated carbon materials prepared form different carbon sources. Activated carbon has been applied for the treatment of cystitis and was found to be effective and nontoxic compared to the antibiotics being applied [180]. Biocompatibility of activated carbon can be attributed to its inertness, and it has also been functionalized and fabricated with other materials to confer on the disinfection properties [181]. The activated carbon is also given orally to human beings as a sorbent for the removal of toxins from the human body and has also been utilized in biomedical applications [182, 183]. These studies strongly suggest the biocompatibility of the activated carbon.
Conclusion
In this review, environmental and special purification of heavy metal from heavy metal contaminants by the applications of carbon nanomaterials, namely fullerene carbon nanotubes, graphene, graphene oxide, and activated carbon discussed. These carbon nanomaterials have been utilized in the purification of heavy metal-contaminated water with great success. The reason behind the successful application is due to their fascinating properties like high surface area, ease of recycling, and easiness to desorb the adsorbed metal ions; only using mineral acid solution and regenerated material can be reused with retention of adsorption capability. In addition to these properties, the carbon nanomaterials can easily be fabricated with other nanomaterials and are easy to be functionalized resulting in multifunctional nano-adsorbent. Carbon-based materials are highly biocompatible with living organisms and environment. There is also an immense effect of different parameters such as pH, contact time, and type of adsorbents on the process of metal ion adsorption. Based on this literature review, it can be concluded that carbon nanomaterials have fascinating physicochemical properties and have great potential to be exploited in the environmental remediation and water purification.
Disponibilité des données et des matériaux
All data are fully available without restriction.
Abréviations
- AC:
-
Activated carbon
- GO:
-
Graphene oxide
- MWCNTs:
-
Multiwall carbon nanotubes
- r-GO:
-
Reduced graphene oxide
- SWCNTs:
-
Single-wall carbon nanotubes
Nanomatériaux
- La formule parfaite pour aligner les opérations et la maintenance
- Les avantages et les inconvénients des bagues en fibre de carbone
- La différence entre la fibre de carbone et la fibre de verre
- Matériaux :PP renforcé de fibre de verre et de carbone pour l'automobile
- Les cinq principaux problèmes et défis de la 5G
- Comprendre le concept de l'IoT dans le traitement et la gestion des eaux usées
- Lampe de poche lunaire pour rechercher de l'eau sur la lune
- La bonne plate-forme pour les bonnes configurations
- L'importance d'un traitement thermique efficace pour les poinçons, les matrices, les lames et les aciers à outils



