Batterie
Contexte
La célèbre expérience de Benjamin Franklin pour attirer l'électricité en faisant voler un cerf-volant dans un orage n'était qu'une des nombreuses expériences de la fin du XVIIIe et du début du XIXe siècle menées pour en savoir plus sur l'électricité. La première batterie a été construite en 1800 par l'italien Alessandro Volta. La soi-disant pile voltaïque consistait en une alternance de disques d'argent et de zinc séparés par du cuir ou du carton trempé dans de l'eau salée, de la lessive ou une solution alcaline. Des bandes de métal à chaque extrémité de la pile étaient reliées à de petites coupelles remplies de mercure. Lorsque Volta a touché les deux tasses de mercure avec ses doigts, il a reçu un choc électrique; plus il assemblait de disques, plus il recevait de secousses.
La découverte de Volta a conduit à d'autres expérimentations. En 1813, Sir Humphrey Davy a construit une pile de 2 000 paires de disques dans le sous-sol de la Royal Institution de Londres. Entre autres applications, Davy a utilisé l'électricité qu'il a produite pour l'électrolyse, catalysant des réactions chimiques en faisant passer un courant à travers des substances (Davy a séparé le sodium et le potassium des composés). Quelques années plus tard, Michael Faraday a découvert le principe de l'induction électromagnétique, utilisant un aimant pour induire de l'électricité dans un fil enroulé. Cette technique est au cœur des dynamos utilisées pour produire de l'électricité dans les centrales électriques aujourd'hui. (Alors qu'une dynamo produit un courant alternatif (AC) dans lequel le flux d'électricité change de direction régulièrement, les batteries produisent un courant continu (DC) qui ne circule que dans un sens.) Une cellule plomb-acide capable de produire une très grande quantité de courant, le précurseur de l' automobile d'aujourd'hui batterie, a été conçu en 1859 par le Français Gaston Planté.
Aux États-Unis, Thomas Edison expérimentait l'électricité à partir de batteries et de dynamos pour alimenter l'ampoule électrique, qui a commencé à se répandre aux États-Unis au début des années 1880. Au cours des années 1860, Georges Leclanché invente la cellule humide qui, bien que lourde en raison de ses composants liquides, peut être commercialisée et utilisée commercialement. Dans les années 1870 et 1880, la cellule Leclanché était produite à l'aide de matériaux secs et était utilisée pour un certain nombre de tâches, notamment pour alimenter le téléphone d'Alexander Graham Bell et la lampe de poche nouvellement inventée. Les batteries ont ensuite été utilisées pour alimenter de nombreuses autres inventions, telles que la radio, qui est devenue extrêmement populaire dans les années qui ont suivi la Première Guerre mondiale. Aujourd'hui, plus de vingt milliards de cellules d'alimentation sont vendues chaque année dans le monde, et chaque Américain utilise environ 27 piles par an.
Conception
Toutes les batteries utilisent des procédures similaires pour créer de l'électricité ; cependant, des variations dans les matériaux et la construction ont produit différents types de batteries. À proprement parler, ce que l'on appelle communément une batterie est en fait un groupe de cellules liées. Ce qui suit est une description simplifiée du fonctionnement d'une batterie.
L'anode et la cathode sont deux parties importantes de toute cellule. La cathode est un métal qui est combiné, naturellement ou en laboratoire, avec de l'oxygène - la combinaison s'appelle un oxyde . L'oxyde de fer (rouille), bien que trop fragile pour être utilisé dans une batterie, est peut-être l'oxyde le plus connu. Certains autres oxydes sont en fait assez forts pour être travaillés (coupés, pliés, façonnés, moulés, etc.) et utilisés dans une cellule. L'anode est un métal qui s'oxyderait si on le laissait faire et, toutes choses étant égales par ailleurs, est plus susceptible de s'oxyder que le métal qui fait partie de la cathode.
Une cellule produit de l'électricité lorsqu'une extrémité d'une cathode et une extrémité d'une anode sont placées dans une troisième substance qui peut conduire l'électricité, tandis que leurs autres extrémités sont connectées. L'anode attire des atomes d'oxygène vers elle, créant ainsi un flux électrique. S'il y a un interrupteur dans le circuit (semblable à n'importe quel interrupteur mural ou de lampe), le circuit n'est pas complet et l'électricité ne peut circuler que si l'interrupteur est en position fermée. Si, en plus de l'interrupteur, il y a autre chose dans le circuit, comme une ampoule, l'ampoule s'allumera à cause du frottement des électrons qui la traversent.
La troisième substance dans laquelle l'anode et la cathode sont placées est appelée électrolyte . Dans de nombreux cas, ce matériau est une combinaison chimique qui a la propriété d'être alcaline. Ainsi, une pile alcaline est une pile qui utilise un électrolyte alcalin. Une cellule ne produira pas d'électricité par elle-même à moins qu'elle ne soit placée dans un circuit qui a été rendu complet par un simple interrupteur, ou par une autre connexion de commutation dans l'appareil utilisant la batterie.
La conception d'une cellule peut entraîner de nombreuses variations de type et de structure. Tous les électrolytes, par exemple, ne sont pas alcalins. De plus, le conteneur pour l'électrolyte peut servir à la fois de conteneur et de cathode ou d'anode. Certaines cellules tirent leur oxygène non pas d'une cathode mais directement de l'air. Des changements dans les compositions de l'anode et de la cathode fourniront plus ou moins d'électricité. Un réglage précis de tous les matériaux utilisés dans une cellule peut affecter la quantité d'électricité pouvant être produite, le taux de production, la tension à laquelle l'électricité est fournie tout au long de la durée de vie de la cellule et la capacité de la cellule à fonctionner à différentes températures .
Toutes ces possibilités existent, en effet, et leurs diverses applications ont produit les nombreux types de piles disponibles aujourd'hui (lithium, mercure, etc.). Pendant des années, cependant, la pile la plus courante a été la pile alcaline de 1,5 volt.
Différentes batteries fonctionnent mieux dans différentes circonstances. La pile alcaline de 1,5 volts est idéale pour les équipements photographiques, les ordinateurs de poche et calculatrices, les jouets, les magnétophones et autres utilisations « à forte consommation » ; il est également bon à basse température. Cette cellule a une caractéristique de décharge en pente - elle perd de la puissance progressivement, plutôt que de cesser de produire de l'électricité soudainement - et perdra peut-être quatre pour cent de sa puissance par an si elle n'est pas utilisée sur une étagère.
D'autres types de batteries incluent une batterie au lithium/dioxyde de manganèse, qui a une caractéristique de décharge plate - elle fournit approximativement la même quantité d'énergie au début de sa vie qu'à la fin - et peut être utilisée là où il y a un besoin de petit, batteries haute puissance (détecteurs de fumée, caméras, sauvegardes de la mémoire sur les ordinateurs, etc.). Les aides auditives, les téléavertisseurs et certains autres types d'équipements médicaux utilisent fréquemment des piles bouton zinc-air, qui fournissent une densité d'énergie élevée lors d'une décharge continue. Une pile au mercure est fréquemment utilisée dans bon nombre des mêmes applications que la pile zinc-air, car elle fournit également une tension de sortie constante.
Matières premières
Cette section, ainsi que la section suivante, se concentrera sur les piles alcalines. Dans une pile alcaline, le cylindre qui contient les cellules est en acier nickelé. Il est garni d'un séparateur qui sépare la cathode de l'anode et est constitué soit de papier en couches, soit d'un matériau synthétique poreux. La cartouche est scellée à une extrémité avec un scellant d'asphalte ou d'époxyde qui sous-tend une plaque d'acier, et à l'autre avec un clou en laiton enfoncé à travers le cylindre. Ce clou est soudé à un embout métallique et passé à travers un joint extérieur en plastique. A l'intérieur du cylindre, la cathode est constituée d'un mélange de dioxyde de manganèse, de graphite et d'une solution d'hydroxyde de potassium; l'anode comprend de la poudre de zinc et un électrolyte d'hydroxyde de potassium.
Le processus de fabrication
La cathode
- 1 Dans une pile alcaline, la cathode fait également partie du conteneur. D'énormes charges des ingrédients constitutifs - dioxyde de manganèse, noir de carbone (graphite) et un électrolyte (hydroxyde de potassium en solution) - sont
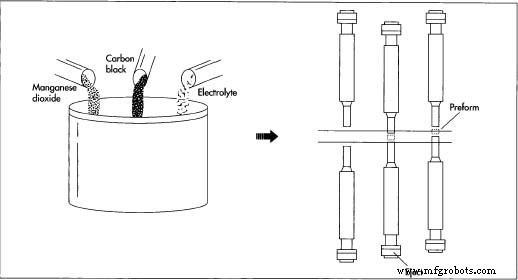 Le mélange des ingrédients constitutifs est la première étape de la fabrication d'une batterie. Après granulation, le mélange est ensuite pressé ou compacté en préformes - cylindres creux. Le principe du compactage est simple :un poinçon en acier descend dans une cavité et compacte le mélange. Au fur et à mesure qu'il se rétracte, un poinçon par le bas monte pour éjecter la préforme compactée. livrés par train et mélangés en très gros lots sur le site de production. Le mélange est ensuite granulé et pressé ou compacté en cylindres creux appelés préformes. Selon la taille de la batterie à fabriquer, plusieurs préformes peuvent être empilées les unes sur les autres dans une batterie. Alternativement, la série de préformes peut être remplacée par un anneau extrudé du même matériau.
Le mélange des ingrédients constitutifs est la première étape de la fabrication d'une batterie. Après granulation, le mélange est ensuite pressé ou compacté en préformes - cylindres creux. Le principe du compactage est simple :un poinçon en acier descend dans une cavité et compacte le mélange. Au fur et à mesure qu'il se rétracte, un poinçon par le bas monte pour éjecter la préforme compactée. livrés par train et mélangés en très gros lots sur le site de production. Le mélange est ensuite granulé et pressé ou compacté en cylindres creux appelés préformes. Selon la taille de la batterie à fabriquer, plusieurs préformes peuvent être empilées les unes sur les autres dans une batterie. Alternativement, la série de préformes peut être remplacée par un anneau extrudé du même matériau. - 2 Les préformes sont ensuite insérées dans un bidon en acier nickelé; la combinaison des préformes et de l'acier peut constituer la cathode de la batterie. Dans une grande opération, les boîtes sont fabriquées à l'usine de batteries en utilisant des techniques standard de découpe et de formage. Une indentation est faite près du haut de la boîte, et un scellant d'asphalte ou d'époxyde est placé au-dessus de l'indentation pour protéger contre les fuites.
Le séparateur
- 3 Un séparateur en papier imbibé de la solution électrolytique est ensuite inséré à l'intérieur du bidon contre les préformes; le séparateur est composé de plusieurs morceaux de papier posés en travers les uns aux autres (comme du contreplaqué). En regardant une boîte ouverte, on pourrait voir ce qui ressemble à un gobelet en papier inséré dans la boîte. Le séparateur empêche le matériau cathodique d'entrer en contact avec le matériau anodique. Comme alternative, un fabricant peut utiliser une fibre synthétique poreuse dans le même but.
L'anode
- 4 L'anode va ensuite dans la batterie. Il s'agit d'un gel composé principalement de poudre de zinc, ainsi que d'autres matériaux, notamment un électrolyte d'hydroxyde de potassium. Ce gel a la consistance d'une pâte très épaisse. Plutôt qu'une solution, c'est chimiquement une suspension, dans laquelle les particules ne se déposent pas (bien qu'un filtre approprié puisse les séparer). Le gel ne remplit pas le bidon jusqu'en haut afin de laisser place aux réactions chimiques qui se produiront une fois la batterie mise en service.
Les sceaux
- 5 Bien que la batterie soit capable de produire de l'électricité à ce stade, une cellule ouverte n'est pas pratique et épuiserait son potentiel rapidement. La batterie doit être scellée avec trois composants connectés. Le premier, un « clou » ou une longue pointe en laiton, est inséré au milieu de la boîte, à travers le matériau en gel et sert de « collecteur de courant ». Le second est un joint en plastique et le troisième un embout en métal. L'ongle, qui s'étend sur environ les deux tiers
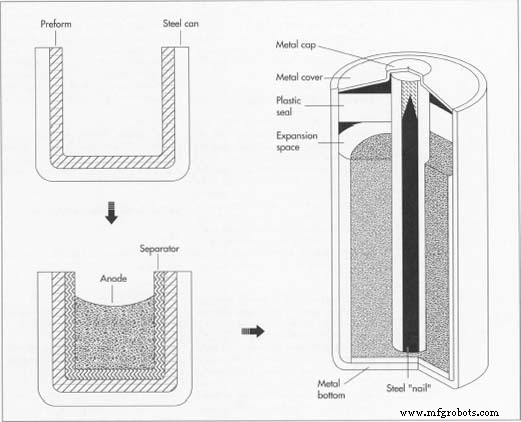 Le conteneur d'une pile alcaline typique, constitué d'une préforme insérée dans une boîte en acier, sert également de cathode. L'anode au milieu est un gel composé principalement de poudre de zinc. Le séparateur entre l'anode et la cathode est soit en papier, soit en fibre synthétique trempée dans une solution d'électrolyte.
Le conteneur d'une pile alcaline typique, constitué d'une préforme insérée dans une boîte en acier, sert également de cathode. L'anode au milieu est un gel composé principalement de poudre de zinc. Le séparateur entre l'anode et la cathode est soit en papier, soit en fibre synthétique trempée dans une solution d'électrolyte.
Dans la batterie finie, un joint en plastique, un clou en acier et un haut et un bas en métal ont été ajoutés. Le clou est soudé au fond métallique et s'étend sur environ les deux tiers du chemin dans la boîte, à travers l'anode. du chemin dans la boîte, est soudé au capuchon d'extrémité en métal, puis passé à travers le joint en plastique. - 6 Ce joint est nettement plus fin à certains endroits qu'à d'autres, de sorte que si trop de gaz s'accumule dans le bidon, le joint se rompra plutôt que la batterie entière. Certains modèles de batteries utilisent un trou rempli de cire dans le plastique; l'excès de gaz pousse à travers la cire plutôt que de rompre la batterie. L'ensemble d'étanchéité rencontre l'empreinte faite dans la boîte au début du processus et est serti en place.
- 7 L'extrémité opposée de la boîte (l'extrémité positive de la batterie) est ensuite fermée avec une plaque d'acier qui est soit soudée en place, soit collée avec un ciment de type époxy.
L'étiquette
- 8 Avant que la batterie ne quitte l'usine, une étiquette est ajoutée identifiant le type de batterie, sa taille et d'autres informations. L'étiquette est souvent en papier qui est simplement collé sur la batterie. Un grand fabricant fait imprimer le design de son étiquette sur une pellicule plastique rétractable :un morceau de plastique thermosensible lâche est enroulé autour de la boîte de batterie, puis exposé à un souffle de chaleur qui fait que le plastique rétrécit pour s'adapter étroitement autour de la boîte.
Contrôle qualité
Parce que la technologie des batteries n'est pas particulièrement nouvelle ou exotique, le contrôle de la qualité et ses résultats sont particulièrement importants en tant que base de la concurrence entre les marques. La capacité d'une batterie à résister à la corrosion, à bien fonctionner dans diverses conditions, à maintenir une bonne durée de vie et d'utilisation, et d'autres facteurs, sont les résultats directs du contrôle qualité. Les batteries et les ingrédients sont inspectés et testés à presque toutes les étapes du processus de production, et les lots terminés sont soumis à des tests rigoureux.
Problèmes environnementaux
Bien que la fabrication de batteries présente certains obstacles environnementaux, aucun n'est insurmontable. Le zinc et le manganèse, les principaux produits chimiques des piles alcalines, ne posent pas de problèmes environnementaux et tous deux sont considérés comme sûrs par la Food and Drug Administration (FDA). Le principal polluant potentiel des piles est le mercure, qui accompagne généralement le zinc et qui a été pendant de nombreuses années ajouté aux piles alcalines pour favoriser la conductivité et empêcher la corrosion. Au milieu des années 1980, les piles alcalines contenaient généralement entre cinq et sept pour cent de mercure.
Lorsqu'il est devenu évident il y a plusieurs années que le mercure était un danger pour l'environnement, les fabricants ont commencé à chercher des moyens de produire des batteries efficaces sans lui. La principale méthode pour ce faire se concentre sur un meilleur contrôle de la pureté des ingrédients. Les piles alcalines d'aujourd'hui peuvent contenir environ 0,025 % de mercure. Des piles sans mercure ajouté du tout (il s'agit d'un élément naturel, il serait donc difficile de garantir un produit exempt même de traces) sont disponibles auprès de certains fabricants et seront la règle dans l'ensemble de l'industrie plutôt que l'exception à la fin de 1993.
Le futur
Les batteries font actuellement l'objet d'intenses recherches menées par des scientifiques et des ingénieurs du monde entier. La raison est simple :plusieurs innovations clés dépendent de la création de meilleures batteries. Les automobiles électriques viables et les appareils électroniques portables qui peuvent fonctionner pendant de longues périodes sans avoir besoin d'être rechargés doivent attendre que des batteries plus légères et plus puissantes soient développées. Les batteries au plomb typiques actuellement utilisées dans les automobiles, par exemple, sont trop volumineuses et ne peuvent pas stocker suffisamment d'électricité pour être utilisées dans les automobiles électriques. Les batteries au lithium, bien que légères et puissantes, ont tendance à fuir et à prendre feu.
Au début de 1993, des scientifiques de l'Arizona State University ont annoncé qu'ils avaient conçu une nouvelle classe d'électrolytes en dissolvant de l'oxyde de polypropylène et de l'oxyde de polyéthylène dans une solution de sel de lithium. Les nouveaux électrolytes semblent être hautement conducteurs et plus stables que les électrolytes au lithium typiques, et les chercheurs essaient maintenant de construire des prototypes de batteries qui utilisent les substances prometteuses.
Entre-temps, plusieurs fabricants développent des batteries nickel-hydrure métallique plus grosses et plus puissantes pour les ordinateurs portables. Ces nouvelles batteries devraient apparaître fin 1994.
Processus de fabrication



