Présentation des progrès récents des nanobiocapteurs à base d'oxyde métallique/graphène/CNT
Résumé
Les nanobiocapteurs sont des analyseurs pratiques, pratiques et sensibles qui détectent les agents chimiques et biologiques et convertissent les résultats en données significatives entre une molécule biologiquement active et un élément de reconnaissance immobilisé à la surface du transducteur de signal par un détecteur physico-chimique. En raison de leurs caractéristiques de fonctionnement rapides, précises et fiables, les nanobiocapteurs sont largement utilisés dans les applications cliniques et non cliniques, les tests au chevet, l'industrie textile médicale, la surveillance environnementale, la sécurité alimentaire, etc. Ils jouent un rôle important dans ces applications critiques. Par conséquent, la conception de l'interface de biodétection est essentielle pour déterminer les performances du nanobiocapteur. Les propriétés chimiques et physiques uniques des nanomatériaux ont ouvert la voie à de nouveaux dispositifs de détection améliorés dans les biocapteurs. La demande croissante de dispositifs dotés d'une capacité de détection et de sélectivité améliorée, d'un temps de réponse court, d'une limite de détection inférieure et d'un faible coût entraîne l'utilisation de nouvelles études sur les nanobiomatériaux comme échafaudages de biocapteurs. Parmi tous les autres nanomatériaux, des études sur le développement de nanobiocapteurs à base de nanostructures d'oxyde métallique, de graphène et de ses dérivés, de nanotubes de carbone, et l'utilisation généralisée de ces nanomatériaux en tant que structure hybride ont récemment attiré l'attention. Les structures nanohybrides créées en combinant ces nanostructures répondront directement aux besoins des futurs biocapteurs avec leurs activités électrocatalytiques élevées. Cette revue a porté sur les développements récents sur ces nanomatériaux et leurs dérivés, et leur utilisation comme échafaudages de biocapteurs. Nous avons examiné ces nanomatériaux populaires en les évaluant à l'aide d'études comparatives, de tableaux et de graphiques.
Introduction
Un biocapteur est un dispositif de diagnostic qui convertit les signaux d'un analyte biologique en un signal électrique mesurable et distinguable pour une détection qualitative et/ou quantitative de l'analyte qui peut être mêlé à d'autres substances physicochimiques [1]. Le premier biocapteur connu a été développé par Clark et al. [2] pour la détection de l'oxygène, et la première électrode à enzyme ampérométrique développée par Clark et Lyons [3] était un biocapteur de glucose à base d'enzyme. Au fil des ans, des types de biocapteurs à base d'enzymes, de tissus, d'acide désoxyribonucléique (ADN) et thermiques, optiques et électrochimiques ont été développés. Les biocapteurs donnent des résultats plus stables et précis que les méthodes traditionnelles dans certaines applications comme le diagnostic clinique, le secteur biomédical, la production alimentaire et l'analyse [2, 4]. De plus, avec des caractéristiques telles que la spécificité, la sélectivité et les économies de coûts avec une opération simple, une analyse en temps réel et une utilisation continue, divers types de biocapteurs ont été développés rapidement au cours de la seconde moitié du siècle et sont devenus largement utilisés dans les domaines médicaux, domaines environnementaux et médico-légaux [5]. Leur utilisation intensive dans ces domaines d'application critiques a émergé des caractéristiques attendues d'un biocapteur comme une sensibilité élevée, une stabilité, une sélectivité élevée, une longue durée de vie, une répétabilité, une simplicité et un faible coût, une large plage de mesure et un temps de réponse rapide [6].
Selon l'Union internationale de chimie pure et appliquée (IUPAC), les biocapteurs contiennent trois composants principaux :un élément de reconnaissance biologique, un composant transducteur et un système électronique qui est souvent associé à un transducteur. En tant que dispositifs intégrés récepteur-transducteur, les biocapteurs sont capables de fournir des informations analytiques quantitatives ou semi-quantitatives sélectives à l'aide d'un élément de reconnaissance biologique [7] (Fig. 1). Dans ce cadre, des acides nucléiques, des enzymes, des anticorps, des récepteurs, des micro-organismes, des cellules, des tissus et même des structures biomimétiques peuvent être utilisés comme biorécepteurs pour la détection biologique.
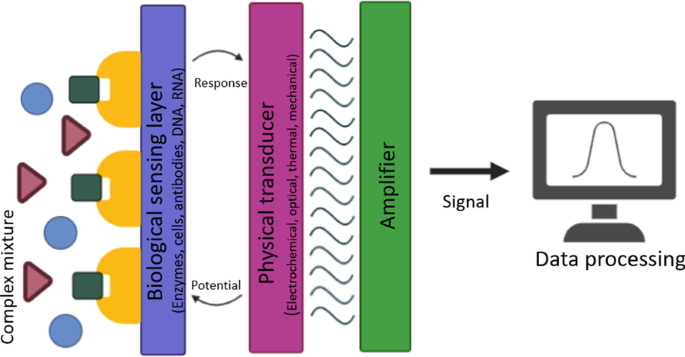
Représentation schématique des biocapteurs
La conception d'un biocapteur est d'une grande importance pour un test rapide et pratique dans toutes les circonstances ou dans toutes les positions où l'analyte peut émerger. Dans cette conception, les matériaux des composants du transducteur ont également un effet significatif sur la qualité de la détection. Les transducteurs physiques varient considérablement avec la source de signal quantifiable et utilisent principalement des systèmes optiques et électrochimiques [5]. Les caractéristiques physico-chimiques, électroniques/optiques/électrochimiques du matériau utilisé comme transducteur physique affectent directement les performances des biocapteurs. De plus, l'efficience et l'efficacité des biocapteurs sont déterminées par les matrices, les médiateurs et les stabilisants utilisés pour l'immobilisation des enzymes. Par conséquent, les propriétés du matériau à partir duquel le composant physique du transducteur est produit jouent un rôle essentiel dans l'obtention de caractéristiques telles que la stabilité élevée du signal et la répétabilité des biocapteurs et dans leur sélectivité. Parmi les trois composants susmentionnés d'un biocapteur, cette revue se concentre principalement sur le développement récent de la fonctionnalisation de surface des composants du transducteur à l'aide de nanomatériaux.
Les transducteurs peuvent être classés principalement en quatre classes :électrochimiques, bioluminescents, piézoélectriques, calorimétriques et optiques. La surface du transducteur peut être modifiée en utilisant de nombreux matériaux fonctionnels différents afin d'améliorer les performances du capteur. Le contrôle de la structure, de la morphologie et des propriétés de ces matériaux peut également aider de la même manière. Parmi ces matériaux, les matériaux nanométriques, appelés nanomatériaux, ont un grand potentiel pour être cruciaux pour le développement de nouveaux biocapteurs, adaptatifs et hautement sensibles pour un domaine d'application plus large avec leurs propriétés uniques dépendantes de la taille telles qu'une grande surface, une amélioration électrique conductivité et une réactivité chimique élevée. Compte tenu de ces propriétés extraordinaires, les nanomatériaux ont été l'un des candidats privilégiés pour répondre aux exigences souhaitées pour la construction de biocapteurs hautement sensibles [6].
Pour être considéré comme un nanomatériau, au moins dans une dimension la taille d'un nanomatériau doit être comprise entre 1 et 100 nm [8]. En raison de leur très petite taille, dans les nanomatériaux, la plupart des atomes existent près de la surface ou présents sur la surface. Ces nanoparticules (NP), dûment dotées de caractéristiques remarquables telles que des propriétés physico-chimiques améliorées, une surface spécifique plus élevée, une distance d'électrons raccourcie, font ressortir une différence significative par rapport à celles de leurs homologues de taille en vrac. Ainsi, des performances améliorées seraient maintenues dans les propriétés optiques, thermiques, électriques et magnétiques de ces matériaux à l'échelle nanométrique pour être très efficaces pour une utilisation en tant que composant de biocapteur. De plus, les matériaux nanométriques ayant une surface spécifique plus élevée offrent un espace approprié pour l'immobilisation d'un nombre suffisant de biorécepteurs à la surface des électrodes. Par conséquent, les chercheurs ont récemment montré un grand intérêt pour la production, la caractérisation et l'utilisation de nanomatériaux pour des applications de biocapteurs [9, 10].
Parmi tous les nanomatériaux, les MON, le graphène et ses dérivés et les NTC se sont distingués par leurs caractéristiques uniques [11, 12]. Les MON présentent des propriétés catalytiques importantes en raison de leur impressionnante diversité morphologique, de leur non-toxicité et de leur biocompatibilité. Il convient également de noter que les MONs fournissent une structure appropriée pour l'immobilisation des biomolécules.
Leur réseau cristallin permettant la modification des paramètres de la cellule et des propriétés électrochimiques en raison de l'effet de confinement quantique, et la contrôlabilité de la bande interdite en modifiant leurs propriétés de surface affectant la conductivité et la réactivité chimique les ont rendus hautement potentiels pour être utilisés comme éléments de biodétection et différencier les MON de leur masse. homologues [12, 13]. De plus, pour améliorer encore ces propriétés en formant une structure composite, les MON ont récemment été largement combinés avec des nanomatériaux de carbone tels que le graphène et les NTC pour former une structure nanohybride. Cela améliore la réactivité électrochimique pour la détection et le diagnostic afin de répondre aux exigences futures telles que la sensibilité et la sélectivité d'un biocapteur [14].
L'hybridation de ces nanomatériaux de carbone avec des MON permet la production de biocapteurs avancés avec une ou plusieurs fonctions dotées de propriétés optiques, magnétiques et électriques supérieures [14,15,16]. Le graphène et ses dérivés peuvent être facilement intégrés à d'autres nanomatériaux pour créer des matériaux nanohybrides afin d'obtenir l'activité électrochimique souhaitée [13, 17, 18]. Par exemple, dans de nombreuses applications, le graphène est considéré comme un outil utile pour favoriser le transfert d'électrons vers la réponse redox des protéines [19]. Cependant, la stabilité physique du graphène dans l'environnement biologique et son évaluation de la toxicité pour les cellules sont encore controversées [20,21,22]. D'autre part, les CNT, contrairement au graphène, ont des caractéristiques optiques variables en raison de leur chiralité changeante, ce qui les rend avantageux par rapport au graphène dans les applications de biodétection optique [23]. Les NTC, ayant une capacité électrochimique exceptionnelle, sont facilement modifiables chimiquement et ont un rapport surface / volume élevé comme le graphène [24]. En termes de propriétés de surface, lorsqu'il est exposé à un environnement ambiant, bien que le graphène soit exposé dans tout son volume en raison de sa nature bidimensionnelle monocouche, cette exposition est limitée dans le cas des NTC unidimensionnels (1D) [25]. De plus, il a été rapporté à plusieurs reprises dans des études antérieures que le graphène a une plus grande sélectivité contre les interférences en raison de ses excellentes propriétés de détection biomoléculaire et de rapport signal/bruit par rapport à celles des NTC. Cela est principalement dû aux bords graphitiques sans métal du graphène avec une surface spécifique élevée. Néanmoins, des problèmes tels que la perturbation du signal existent dans les biocapteurs à base de NTC en raison de la présence de catalyseurs métalliques résiduels [25]. Avec tous les aspects susmentionnés, les nanohybrides formés par la combinaison de structures de graphène et/ou de NTC pourraient jouer un rôle vital dans la conception de biocapteurs avancés, et la compensation des inconvénients des deux matériaux en formant une structure composite à partir d'eux permettrait de surmonter ces problèmes et la détection pourrait être maximisé. Profitant de la coopération créée par la structure composite des MON, du graphène et des NTC, il semble indispensable de fournir une amplification du signal améliorée et de préparer des stratégies de bioaffinité avancées, entraînant le développement de dispositifs de biodétection améliorés pour répondre aux besoins futurs. Par conséquent, dans le cadre de cette revue, il s'est concentré sur les biocapteurs à base de MON, de graphène et de CNT récemment réalisés. De plus, le rôle critique de l'utilisation de ces nanomatériaux, non pas seuls, mais aussi ensemble, dans la production de biocapteurs aux propriétés supérieures obtenues par leur combinaison a été discuté. En évaluant les attentes et les défis futurs, nous souhaitons proposer une perspective alternative pour des études ultérieures.
Biocapteurs à base de nanostructures d'oxydes métalliques
Les oxydes métalliques (MO) ont été des candidats essentiels pour les applications de capteurs depuis les premières études de biocapteurs en 1954 [26, 27]. Les MO peuvent être synthétisés dans diverses nanomorphologies telles que les NPs [28, 29], les nanofibres [30], les nanosphères (NSs) [31], les nanotiges [32], les nanotubes et les nanofils (NWs) [33], les nanofeuilles [34, 35] . Outre la polyvalence morphologique, les MON offrent certains avantages :rapport surface/volume élevé, non toxicité, bonne biocompatibilité, stabilité chimique, excellente sélectivité, limitation des électrons et des phonons, efficacité catalytique élevée et forte capacité d'adsorption, caractéristiques d'interface physico-chimique [36,37,38, 39,40]. De plus, les MON peuvent être produits via des méthodes relativement simples et économiques telles que la pulvérisation cathodique par magnétron radiofréquence (RF) [41,42,43], l'évaporation thermique [44, 45], le dépôt chimique en phase vapeur assisté par plasma (PECVD) [46 , 47], épitaxie par jet moléculaire [48] et technique solgel [49], procédé de dépôt électrochimique [50] et méthode hydrothermale [51]. Ces caractéristiques importantes ont fait des MON l'un des matériaux les plus recherchés pour les applications biomédicales et le marché des biocapteurs. Les publications sur les MON de 2010 à 2020 ont été analysées et sont présentées dans la Fig. 2 avec un diagramme circulaire présenté comme la distribution des applications biomédicales des MON.
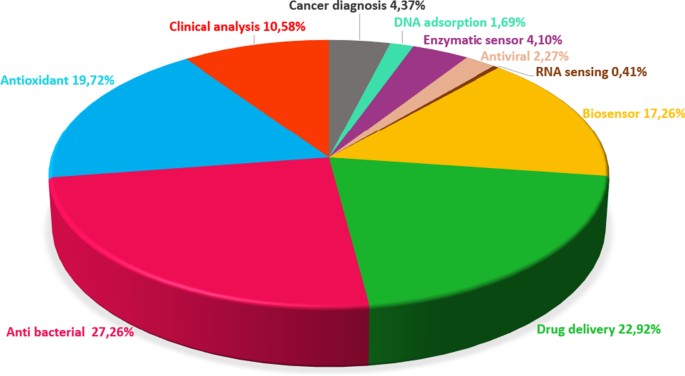
Diagramme circulaire montrant la distribution des MON dans les applications biomédicales
D'autre part, principalement ces dernières années, divers MON tels que ZnO, Fe3 O4 , CuO, NiO, TiO2 , MgO ont été produits en continu en tant que biocapteurs polyvalents et fonctionnels pendant longtemps [44, 52]. Parmi les MON, ZnO et Fe3 O4 , en raison de leurs applications répandues, sont considérés comme des membres éminents dans la construction de biocapteurs [53, 54].
Nanostructures ZnO
Les nanostructures de ZnO jouent un rôle important dans la fabrication de nouveaux biocapteurs nanostructurés en raison de leurs propriétés uniques, notamment un point isoélectrique élevé (IEP ~ 9,5) [55], une large bande interdite, une fonction de communication électronique utile, une stabilité chimique élevée, une bonne biocompatibilité, et la piézoélectricité. En particulier, son point isoélectrique élevé explique clairement pourquoi le ZnO est l'oxyde métallique le plus utilisé pour les technologies de biodétection. De plus, le ZnO peut être utilisé dans toutes les applications cliniques ou non cliniques car il s'agit d'un matériau respectueux de l'environnement et sûr [53, 54, 56]. Par exemple, Akhtar et al. [57] ont développé un biocapteur optique sans réactif basé sur le mécanisme d'amélioration de la fluorescence pour la détection de l'amyloïde dans le diagnostic des maladies neurodégénératives comme la maladie d'Alzheimer et le diabète de type II insulinodépendant en utilisant des nanostructures de ZnO en forme de fleur qui ont une plus grande surface. . En outre, il a été rapporté que la nanofleur de ZnO est un bon matériau améliorant les performances qui fournit un biocapteur amyloïde plus rapide et rentable [57]. En outre, un biocapteur de glucose utilisant un transistor à effet de champ (FET) à base de nanotiges de ZnO lié à une application de surveillance continue du glucose portable pour les personnes atteintes de diabète a été fabriqué par Zong et Zhu [54] via une méthode hydrothermale. Ils ont obtenu un biocapteur hautes performances avec une sensibilité élevée de 1,6 mA/µM cm 2 avec une zone de détection minuscule de 180 µm 2 et une limite de détection de 1 µM grâce au grand rapport surface/volume des nanotiges de ZnO [54]. Sahyar et al. [58] ont développé un nouveau biocapteur à base de NPs ZnO dopé Ag pour la détection précoce de la détérioration de la viande. À la suite de leur analyse avec une électrode modifiée par l'enzyme xanthine oxydase (XO) (électrode nanoAg-ZnO/polypyrrole (PPy)/crayon graphite), ils ont déclaré que le biocapteur enzymatique qu'ils ont obtenu montrait une sélectivité élevée avec une sensibilité de 0,03μA/mM et Limite de détection basse de 0,07 μM [58].
Dans une autre étude, Yue et al. [59], ont développé avec succès un biocapteur de dopamine (DA) idéal basé sur des électrodes en mousse de graphène / nanocônes Au NPs-ZnO. Dans leurs caractérisations, ils ont prouvé que l'électrode qu'ils ont modifiée a une sensibilité élevée (4,36 μA μM −1 ) et une limite de détection basse (0,04 μM, S/N = 3) dans la détection de DA. En outre, ils ont signalé que l'électrode à base de nanocône de ZnO présentait une excellente sélectivité, une bonne reproductibilité et une stabilité sous l'interférence de l'acide urique (UA). Ils ont également souligné que l'électrode a un potentiel énorme en médecine et dans les soins de santé [59]. La même année, Qian et al. développé un détecteur de glucose électrochimique utilisant des NP de ZnO. Le capteur se compose d'un CeO2 nanowhisker décoré de ZnO NPs, et ils ont déclaré que le ZnO/CeO2 La structure nanocomposite a une surface étendue, une non-toxicité et une activité électrocatalytique élevée. Le nanocomposite a montré des performances extraordinaires pour détecter le glucose avec une plage linéaire de 0,5 à 300 μM et une limite de détection (LOD) de 0,224 μM (40 ppb). Ils ont également souligné que le capteur nanocomposite montrait une excellente relation linéaire entre l'intensité du signal actuel et la concentration de glucose (R 2 = 0.99944) [60]. Un autre biocapteur de glucose a été développé par Rafiee et al. [61] en combinant des nanoplaquettes de graphène (GNP), connues pour leur haute conductivité et stabilité chimique, et des ZnO NW, connus pour être sensibles au glucose. Dans leur étude, ils ont modifié la structure de l'appareil comme un biocapteur de glucose en synthétisant des NW de ZnO sur des couches minces de GNP à trois concentrations différentes (0,5, 1 et 2 mg), définies comme GNP1, GNP2 et GNP3. Le système a montré que le double effet de ZnO NWs et GNPs a conduit à l'amélioration parfaite pour un biocapteur de glucose efficace. Par exemple, ils ont noté que pour les faibles concentrations de glucose, la réponse de l'appareil augmentait à mesure que la quantité de graphène en solution augmentait et que le temps de réponse du capteur diminuait avec une augmentation du nombre de PNB. De plus, ils ont signalé qu'une stabilité à long terme, à savoir une résistance constante à la relation de concentration, un critère important pour un biocapteur idéal, a été observée dans des échantillons modifiés avec des PNB après exposition à 30 mg/dL de glucose pendant 30 jours. Par conséquent, ils ont présenté un biocapteur de glucose idéal avec des caractéristiques utiles :un temps de réponse de 5 s, une plage de détection de 0,003 à 30 000 mg/dL et une stabilité électrique à long terme [61]. En plus de ces études, d'autres études récentes utilisant différentes nanostructures de ZnO pour la détection de diverses enzymes sont présentées dans le tableau 1.
Compte tenu des études actuelles présentées dans le tableau 1, on peut exprimer que les structures de ZnO sont produites par de nombreuses méthodes avec des morphologies variables, et il continue d'être largement utilisé en raison de sa facilité d'intégration dans les structures composites. Les alternatives de production et la polyvalence morphologique, ainsi que la formation de structures nanocomposites et nanohybrides avec d'autres nanomatériaux, en particulier avec des nanostructures de carbone, offrent un potentiel extraordinaire aux structures ZnO en termes de respect des propriétés attendues avec une efficacité totale dans un biocapteur idéal.
Fe3 O4 Nanostructures
Ces dernières années, Fe3 O4 La nanostructure a suscité beaucoup d'intérêt dans de nombreuses applications prometteuses, notamment les biocapteurs, l'administration de médicaments, la séparation cellulaire et la pharmacie, grâce à ses propriétés supérieures telles qu'une bonne biocompatibilité, une faible toxicité, un superparamagnétisme, une activité catalytique et la facilité de préparation et de processus de modification. Magnétique Fe3 O4 Les NP sont appropriées pour l'immobilisation des biomolécules souhaitées telles que les enzymes [73,74,75,76] en raison de leur simple capacité de séparation du milieu par sa nature magnétique [77]. Fe3 O4 Les NP magnétiques et leurs dérivés ont été largement utilisés dans la technologie des biocapteurs, et diverses études intéressantes ont été discutées dans la littérature [75, 78]. Dans ce contexte, Sanaeifar et al. [75] ont conçu un nouveau biocapteur électrochimique pour la détection du glucose. Ils ont évalué les performances électrochimiques du nanocomposite préparé en dispersant Fe3 O4 NP magnétiques, qui ont été produites par la méthode de co-précipitation dans l'alcool polyvinylique (PVA). Ils ont signalé que Fe3 O4 Les NP dans la matrice PVA, ayant d'excellentes propriétés catalytiques contre la glucose oxydase immobilisée, ont augmenté les taux de transfert d'électrons entre l'enzyme et la surface de l'électrode. La bioélectrode qui a préparé pourrait mesurer le glucose dans la plage de 5 \(\times \hspace{0.17em}\)10 −3 à 30 mM avec une sensibilité de 9,36 µA mM −1 et affichaient une limite de détection inférieure à 8 µM [75]. Dong et al. [79] ont développé Ag/Fe3 O4 capteurs core-shell NSs, produits via une approche solvothermique simple, à utiliser dans la détection de l'hydrazine pour la protection de l'environnement. Ils ont signalé que le capteur d'hydrazine haute performance a un temps de réponse de 2 s, une plage linéaire de 0,25 à 3 400 µm, une sensibilité de 270 μA mM − 1 cm − 2 , et une limite de détection de 0,06 μM. En comparant les chiffres, un capteur d'hydrazine bien supérieur aux autres capteurs de la littérature a été développé [79].
Dans une autre étude, Sriram et al. [80] ont développé Fe3 O4 Nanocomposite NSs/oxyde de graphène réduit (rGO) pour détecter l'UA dans les échantillons d'urine et de sérum sanguin. À la suite de leur analyse électrochimique, Fe3 O4 Les nanocomposites NS/oxyde de graphène réduit (rGO), avec une stabilité et une répétabilité élevées, ont montré un excellent pic de réduction électrochimique. De plus, ils ont souligné que la plage linéaire du capteur UA qu'ils ont développé était comprise entre 0,02 et 783,6 µM, et le LOD était de 0,12 nM [80]. De même, un nouveau biocapteur pour la détection DA en combinant l'oxyde de graphène (GO) et Fe3 O4 a été développé par Cai et al. [81]. Dans leur étude, ils ont réussi à synthétiser Fe3 O4 /GO/composite ternaire de graphène vierge (PG) par des méthodes de dispersion et de co-précipitation. Plus tard, ils ont déposé le nanocomposite sur l'électrode de travail, l'électrode de carbone vitreux (GCE), par technique de goutte. Le courant de crête le plus élevé est enregistré pour Fe3 O4 Structures /GO/PG dans les voltamogrammes cycliques (CV). De même, ils ont signalé que le courant de crête le plus élevé en présence de DA appartient à Fe3 O4 /GO/PG/GCE échantillon. Ils ont également mis en évidence une augmentation du courant de crête pour le Fe3 O4 /GO/PG/GCE en raison de l'augmentation de la concentration en DA. Enfin Cai et al. a déclaré que le capteur électrochimique pourrait être utilisé efficacement dans la détection DA [81]. Quelques études représentatives sur Fe3 O4 les nanostructures en tant que composant de biocapteur sont présentées dans le tableau 2.
Malgré leurs propriétés supérieures, le Fe3 magnétique O4 les nanostructures ont des problèmes restrictifs dans les applications de biocapteurs et biologiques. En raison de leur énergie de surface élevée, de leur réactivité chimique et de leurs fortes interactions magnétiques, ils sont incroyablement sujets à l'agglomération, ce qui crée des difficultés pour stabiliser Fe3 O4 nanostructures magnétiques. Pour pallier ce problème, la surface de Fe3 O4 nanostructures est recouverte des couches polymères [95]. Cependant, le revêtement de la surface avec le polymère peut diminuer l'efficacité en termes d'applications de biocapteurs électrochimiques. Ainsi, en stabilisant Fe3 magnétique O4 des nanostructures, des biomolécules telles que des gènes, des cellules, des enzymes, des protéines, et d'autres nanostructures essentielles (graphène, CNTs, quantum dots, NPs, etc.) peuvent être utilisées. Par conséquent, il peut être prédit que les systèmes nanohybrides et nanocomposites complexes basés sur le Fe3 magnétique O4 les nanostructures deviendront un phénomène dans la production de biocapteurs de nouvelle génération à l'avenir.
Après tout, les biocapteurs à base de MO incorporant diverses nanostructures présentent des fonctions uniques et nouvelles dans des applications pratiques et industrielles. Les nanostructures des MO ont un impact important sur la conception de biocapteurs hautement sensibles, rapides et stables en raison de leurs propriétés inégalées. En outre, chaque type de nanostructures et d'oxydes de métaux a ses avantages. Par conséquent, de nouvelles avancées dans les dispositifs de détection sont susceptibles d'avoir lieu dans le domaine de la biotechnologie. De plus, on constate que les structures de nanocarbone ont reçu beaucoup d'espace dans les études récentes et que les MO sont utilisés avec elles. Par conséquent, la deuxième partie de ce travail se concentrera sur les deux nanocarbones les plus couramment utilisés (le graphène et les NTC) dans les biocapteurs.
le graphène et ses biocapteurs à base de dérivés
Le graphène est l'un des allotropes de carbone les plus populaires, tout comme le graphite, les NTC, le fullerène, le diamant. C'est une couche bidimensionnelle de sp 2 -atomes de carbone hybridés. Après la découverte du graphène par Geim et Novoselov, il a attiré une énorme attention dans le monde entier dans diverses disciplines telles que les électrodes transparentes, le stockage d'énergie, l'administration de médicaments, les biocapteurs, les supercondensateurs, les batteries et la catalyse [96, 97]. Le graphène, comme de nombreux autres nanomatériaux, peut être synthétisé par des méthodes descendantes (exfoliation mécanique, exfoliation chimique et synthèse chimique) et ascendantes (pyrolyse, croissance épitaxiale, dépôt chimique en phase vapeur (CVD)) [97]. Différentes méthodes de production conduisent à la présence de nombreux matériaux de type graphène tels que le graphène, les GQD, GO, rGO, les nanorubans de graphène (GNR), les nanomesh, les nanosheets [98]. Les dérivés fréquemment utilisés sont illustrés à la Fig. 3.
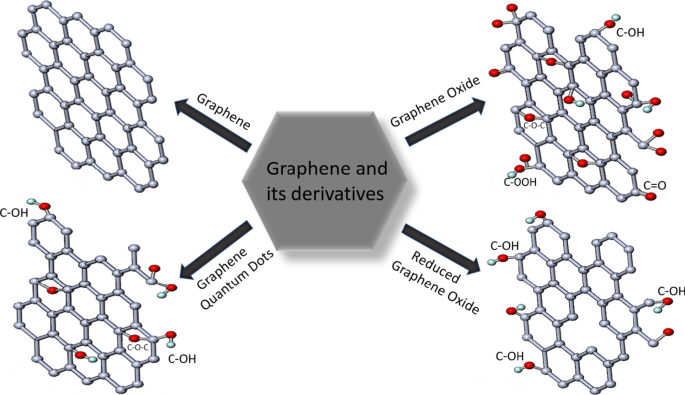
Structure des matériaux à base de graphène les plus populaires
Le graphène a une bonne conductivité thermique (5 000 W/mK), une mobilité élevée des électrons à température ambiante (250 000 cm 2 ) /V s), grande surface (2630 m 2 /g), un module d'élasticité élevé (21 T Pa) et une bonne conductivité électrique [99]. De plus, l'épaisseur atomique des feuilles de graphène et leur grande surface spécifique confèrent une sensibilité du matériau aux changements de conditions. Ainsi, les caractéristiques de surface du graphène, dans lesquelles chaque atome peut être directement contacté, le rendent sensible à l'environnement. Par conséquent, c'est un excellent candidat pour les applications de capteurs par rapport aux autres matériaux [, , 4, 100, 101]. Les études de la dernière décennie liées au graphène et à ses dérivés ont été analysées et sont présentées sur la figure 102 avec un diagramme circulaire qui présente la distribution des applications biomédicales du graphène. On peut affirmer que les chercheurs se concentrent principalement sur le domaine des biocapteurs en raison des caractéristiques du graphène mentionnées ci-dessus.
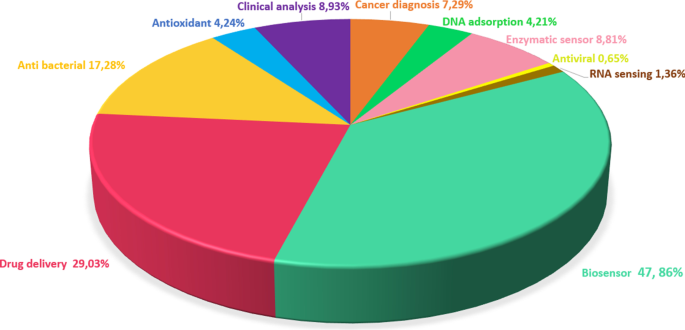
Diagramme circulaire montrant la distribution du graphène dans les applications biomédicales
Comme mentionné dans la première section, certains biocapteurs sont préparés en combinant du graphène et des dérivés du graphène avec des MON. Dans cette partie de la revue, nous nous concentrons sur les biocapteurs basés sur le graphène et ses dérivés. Une représentation générale et un mécanisme des biocapteurs à base de graphène sont illustrés à la figure 5. Ici, les analytes interagissant avec le ou les groupes fonctionnels à la surface du graphène, et des sorties électrochimiques, optiques ou autres peuvent être obtenus sur la base de cette interaction [96 , 97, 103]. Par exemple, Mani et al. [104] ont développé un nanobiocomposite ternaire basé sur les nanorubans rGO/MWCNTs/chitosan pour la détection sensible et sélective de H2 O2 et NON2 − . Ils ont exploré les propriétés bénéfiques du biocapteur dans une solution de nettoyage de lentilles de contact et un échantillon de viande. Ils ont signalé que pour H2 O2 , le capteur à base de nanobiocomposites avait une sensibilité de 0,616 µAµM −1 cm −2 , la limite de détection de 1 nm et une plage linéaire de 0,001 à 1625 µM, tandis que ces valeurs pour NO2 − , 0,643 µAµM −1 cm −2 , 10 nm et 0,01–1350 µM, respectivement. Ainsi, ils ont prouvé que le capteur à base de graphène pouvait être utilisé efficacement dans les applications médicales et la sécurité alimentaire [104]. Un autre H2 à base de graphène O2 capteur a été préparé par Yin et al. [105]. Dans leur étude, Yin et ses collègues ont synthétisé des aérogels de graphène (GA) conducteurs en trois dimensions (3D) décorés de Ni3 N NPs en utilisant la méthode hydrothermale. À la suite de leur caractérisation, ils ont montré que le Ni3 Les composites N/GA qu'ils ont obtenus pourraient être appliqués non seulement pour H2 O2 mais aussi pour la détermination du glucose. Ils ont signalé que le Ni3 Électrode à base de N/GA, dans la détermination de H2 O2 , a démontré des performances électrochimiques élevées comme la plage de détection de 5 µM–75,13 mM, la sensibilité de 101,9 µAmM −1 cm −2 , et une limite de détection basse de 1,80 µM. De plus, pour la détermination du glucose, ils ont souligné que l'électrode conçue a une plage de détection de 0,1 à 764,3 µM, une limite de détection de 0,04 µM et une sensibilité de 905,6 µA mM −1 cm −2 [105].
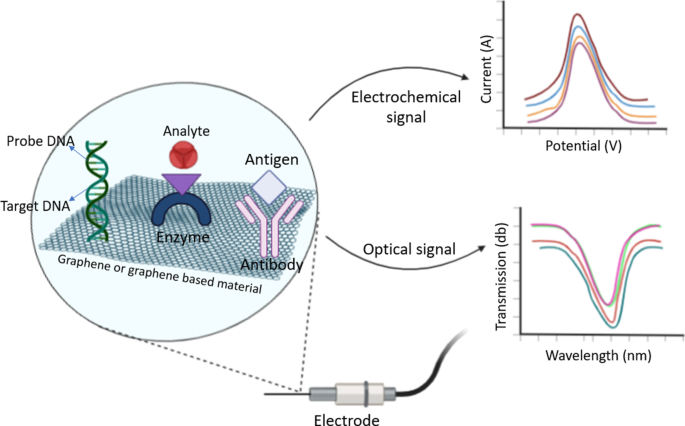
Représentation des biocapteurs à base de graphène et de son mécanisme
On peut dire que récemment, il y a eu un vif intérêt pour les biocapteurs à base de graphène pour la détection pratique du glucose. Tableau 3. Par exemple, Đurđić et al. [106] ont réussi à synthétiser un biocapteur à usage unique basé sur Bi2 O3 -GNR décorés par co-précipitation. À la suite de leur caractérisation, ils ont prouvé que le capteur qu'ils ont obtenu avait une limite de détection de 0,07 mM, une plage linéaire de 0,28 à 1,70 mM et une sensibilité de 64,81 μA/mMcm 2 . Ainsi, ils ont proposé que le capteur à base de graphène puisse détecter le glucose dans des échantillons de sérum sanguin et d'urine reproductibles et stables [106]. La même année, un biocapteur de glucose utile a été conçu avec succès par la synthèse hydrothermale en pot unique d'un hydrogel de graphène poreux dopé à l'azote (NHGH) 3D avec NiCo2 O4 nanofleurs (NHGH/NiCo2 O4 ) par Lu et son équipe. Ils ont modifié le GCE avec le nanocomposite qu'ils ont obtenu et évalué les performances électrochimiques de l'électrode modifiée dans la détermination du glucose. Premièrement, ils ont reçu des CV dans une solution de NaOH 0,1 M, avec une vitesse de balayage de 50 mV s −1 , pour examiner les performances catalytiques électrochimiques. Ils ont signalé que le NHGH/GCE a un courant de pic d'oxydation accru de 0,5 V par rapport au faible courant de pic anodique du GCE nu. De plus, dans leur étude, ils ont observé que la paire de pics redox est visible, ce qui indique que l'activité électrochimique de NHGH/NiCo2 O4 /GCE est le plus élevé par rapport aux autres électrodes. Ils ont attribué cette amélioration à la surface étendue du graphène, bonne conductivité et réactions redox de Co et Ni. De plus, ils ont montré les performances catalytiques électrochimiques des électrodes dans l'addition de glucose à 5,0 mM. Ils ont interprété NHGH/NiCo2 O4 /GCE with the highest peak current at 0.5 V as a clear indication that glucose oxidation could be better catalyzed than other electrodes due to the dual effect of NiCo2 O4 and NHGH. They also reported that the peak currents increased linearly with increasing glucose concentration and the NHGH/NiCo2 O4 -based glucose sensor exhibited a broad linear relationship between peak current and glucose concentration in the range of 5 μM–2.6 mM and 2.6 mM–10.9 mM, respectively. Also, they emphasized that NHGH/NiCo2 O4 /GCE has a high sensitivity (2072 μA mM − 1 cm − 2 ) and a low detection limit (0.39 μM). As a result, they suggested using for a precise determination of glucose in real blood samples [107].
As seen in Table 3, graphene and its derivatives have become an indispensable building block for biosensor applications, because of its excellent properties. Considering the studies performed recently Table 3, it is remarkable that graphene and its derivatives are used in hybrid nanostructures with MONs to improve biosensors' sensitivity and reproducibility. Additionally, MONs/graphene synergy should be evaluated to obtain multifunctional biosensors and achieve high electrocatalytic activity. Moreover, graphene can be easily combined with other nanocarbons such as CNTs. Therefore, rich edge density and highly beneficial edge defects for creating enzymatic biosensors can be obtained.
Carbon Nanotubes-Based Biosensors
CNT's, discovered by Iijima in 1991, can be conceived as the formation of a graphene layer into a cylinder. CNTs can be categorized in general two types as single-walled carbon nanotubes (SWCNTs) Fig. 6a and MWCNTs Fig. 6b [125]. The diameter and wrapping angle determine the physical features of the CNTs by chirality and the (n, m) index [126,127,128]. According to the (n,m) index, CNTs can exhibit metal or semiconductor behavior [129,130,131,132],depending on chirality, SWCNTs may be classified in three different ways:(1) m = n is the armchair nanotube Fig. 6c, (2) n > m and if m = 0 is the chiral nanotube Fig. 6d, and m = 0 is the zig-zag nanotube Fig. 6e. CNTs display the semiconductive behavior in their nature, but for a given (n , m ) SWNT, when (2n + m )/3 is an integer, the CNTs will be metallic. Thus, it can be claimed that all armchair nanotubes are metallic [130]. Therefore, the ability to control chirality during production means to control the electronic features of CNTs, which provides a great advantage in biosensor applications. Several different methods have been proposed to synthesize CNTs in recent years. However, there are three main synthesis techniques (arc discharge, laser ablation, and CVD for CNTs production [133]. Compared to arc-discharge and laser ablation methods, CVD is the most effective method for simple and cost-effective controlling the chirality of CNTs [133, 134].
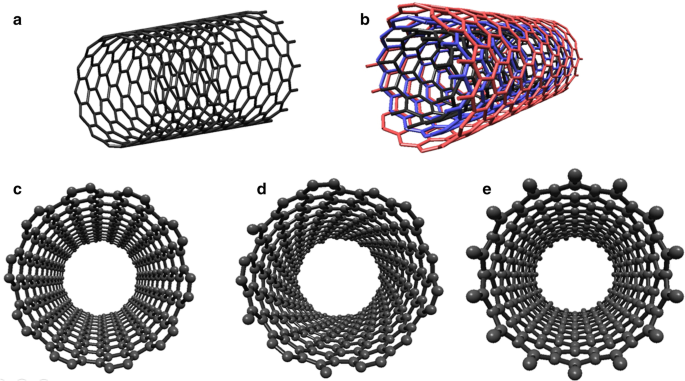
The classification of the CNTs of a SWCNT, b MWCNT; Schematic representation of three typical types of SWCNTs c Armchair (10, 10), d Chiral (13, 6), and e Zigzag (14, 0)
The ends and sidewalls of the CNTs can be easily modified by the addition of virtually any desired chemical species. CNTs can be excellent transducers in nanoscale sensors owing to their significant sensitivity. Additionally, CNTs have very favorable properties for transmitting electrical signals generated upon recognition of a target and therefore play an essential role in the final development of enzyme-based biosensors [135]. Moreover, CNTs with small size, fast response times, and excellent electrochemical properties are equal or superior to most other electrodes with their ions, metabolites, and protein biomarkers [136]. As a result of their unique tubular nanostructures with extensive length and diameter ratios, CNTs are desirable materials in applying electrochemical biosensors due to their excellent electrochemical stability, great mechanical flexibility, rapid electron transport, and unique thermal conductivity [137, 133]. CNTs are also widely used in tissue engineering and drug delivery systems to improve electrical and mechanical features after being functionalized to ensure their biocompatibility and conjugated with organic compounds or metallic NPs. [138]. Studies on CNTs from 2010 to 2020 were analyzed and are presented in Fig. 7 as a pie chart that shows the distribution of biomedical applications of CNTs.
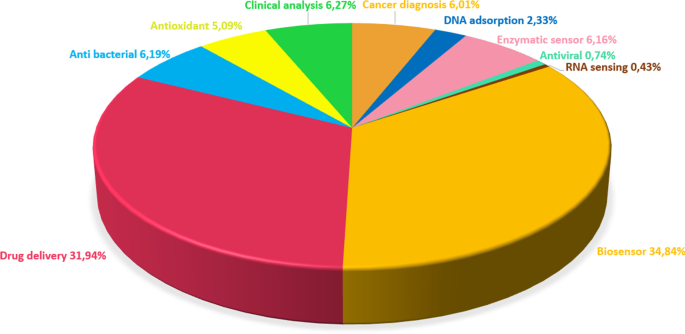
Pie chart showing the distribution of CNTs in biomedical applications
CNTs, as with graphene and its derivatives, also make important contributions to the development of biosensors with higher sensitivity and selectivity by hybridizing with MONs. Researchers have recently focused on the production and characterization of new nanobiosensors that can combine the unique properties of CNTs with the superior properties of metal NPs. For instance, Rahman et al. [139] designed the Fe3 O4 -decorated CNTs based 3-methoxyphenyl (3-MP) biosensor for environmental protection applications. Fe3 O4 /CNTs nanocomposites synthesized by wet-chemical method and coated the nanocomposite on the GCE surface as a thin layer. Then, they evaluated the electrochemical performance of the modified electrodes by I-V characterization and reported that the Fe3 O4 /CNT-based electrode showed a wide detection range (90.0 pM–90.0 mM), low detection limit (1.0 pM), and high sensitivity (9 × 10 −4 μA μM −1 cm −2 ) in detecting dangerous phenol [139]. Similarly, for environmental protection, MWCNT/TiO2 /chitosan-based biosensor was developed by Fotouhi et al. [140] to detect dihydroxy benzene isomers released into the environment from the chemical and pharmaceutical industries. Fotouhi et al. reported that they performed the simultaneous determination of hydroquinone (HQ), catechol (CC), and resorcinol (RS), causing pollution in real water samples by the MWCNTs-based sensor. Additionally, they indicated the detection limits (S /N = 3) of HQ, CC and RS, as 0.06 μmol d m −3 , 0.07 μmol d m −3 , and 0.52 μmol d m −3 , and the linear response ranges are between 0.4–276.0 μmol d m −3 , 0.4–159.0 μmol d m −3 , and 3.0–657 μmol d m −3 , respectively [140].
Besides environmental protection, biosensor designs of CNTs for clinical applications have recently become extremely interesting Table 4. For instance, Zhu et al. [141] obtained the buckypaper containing two layers:purified SWCNTs and SWCNTs decorated with NiO, by helium arc discharge method. Later, as a result of their analysis to evaluate its electrochemical performance, they showed that glucose biosensor has a broad linear range (0.1–9 mM), high sensitivity (2701 μA mM −1 cm −2 ), and fast response time (< 2.5 s) [141]. Barthwal and Singh [142] designed a ZnO/MWCNTs nanocomposite biosensor to detect urea in their study. They indicated that the ZnO/MWCNTs-based sensor has the highest detection characteristics compared to the ZnO and MWCNTs-based sensor. Also, they emphasized that the nanocomposite's sensitivity containing 2% MWCNTs is less than 10 s, and the detection limit is 10 ppm [142]. In the same year, Guan et al. successfully developed a CNTs-based hybrid nanocomposite as an electrochemical biosensor for simultaneous high-sensitivity detection of DA and UA. In their study, they reported that the most extensive (ΔE p = 144 mV) and highest oxidation current was observed in the electrode modified with CNTs-based nanohybrid. Additionally, they investigated the simultaneous detection of DA and UA in nanohybrid-modified GCE via differential pulse voltammetry (DPV). They showed that the anodic peak current response of the nanohybrid/GCE increased linearly due to the increase in DA concentration. Also, they obtained a similar observation for the UA concentration. They emphasized that the concentration range for both target analytes is 2–150 μM. As a result, they reported that the limit of DA and UA detection values was 0.37 μM and 0.61 μM, respectively [143].
Studies on increasing the efficiency of CNTs-based biosensors in different application areas by hybridizing with MONs and graphene and graphene derivatives and improving their properties are of great interest Table 4. The higher electrochemical activity and higher conductivity of nanohybrid structures designed with CNTs-based electrochemical sensors can be considered a result of the inherent properties of CNTs. On the other hand, one of the features that limit the use of CNTs in biosensor applications is that they are not dissolved in most solvents. Also, it has low biocompatibility and, in some cases, toxicity. To overcome these problems, combining different functional groups on the surface and end caps of CNTs with MONs, and applying surface modifications can be considered as a solution.
Additionally, due to the integration of CNTs with graphene and its derivatives, it is possible to create more active sites for biomolecules due to strong binding interactions. Another advantage of CNTs/graphene hybrid structure is that it allows biosensors to respond in a shorter time due to their higher electron transfer rate. Thus, in the next generation of biosensors to be developed in the future, it seems inevitable to achieve high sensitivity and selectivity, simultaneous target biomolecule detection by benefiting from the dually effect of CNTs with MONs or other nanocarbons such as graphene and its derivatives.
Conclusion et Outlook
Biosensors and bioelectrodes play a crucial role in environmental monitoring, food safety, the medical textile industry, drug discovery and analysis, clinical and nonclinical applications. With the recent COVID-19 pandemic, fast responsive, reusable, cheap and highly selective biosensors became crucial for the fight against infectious diseases to be taken under control. For the design of a biosensor, the material used in transducer component and to functionalize transducer surfaces has an explicit effect on the results with aforementioned properties obtained from a biosensor. Within this frame, for the improvement of the properties of these devices, nanomaterials have been extensively used and their expanded surface area, ability to adapt to the surface modifications for the use of any type of analyte, and such extraordinary nanosize-dependent properties brought them one-step ahead unprecedently in the production of an ideal biosensor.
With this motivation, this paper presents an overview on recent developments in hybrid nanosystems created by the combined use of MONs, graphene, and CNTs. Numerous efforts have been made to create biosensors with improved sensitivity and selectivity to detect biomolecules with the help of these nanostructures. Obviously, apart from each of these materials’ unique characteristics, the multiple effect of hybrid design of them is a key point in obtaining a higher performance biosensor. Combining these nanostructures to create a hybrid design improves the biosensor's electrocatalytic activity, its electron transfer rate, and enables more active sites to allow two or more biomolecules to be detected, simultaneously. It also meets other desired functions expected from an ideal biosensor, such as stability, long shelf life, repeatability, wide measuring range, fast response time for next-generation biosensor applications. However, there are compelling factors in combining these three trending nanomaterials, such as the control on agglomeration tendency, cytotoxicity, the choice of the right concentration, and the extensive optimization of conditions to improve purity and these materials better integration with each other. Therefore, there are still open allowance for improvements to be made for the preparation of nanomaterials and their composite structures. Furthermore, for an onsite diagnosis of an analyte, having a major impact for biosensors for medical applications, it is important to have a quick and reliable result in a cost-effective way. For this purpose, nanomaterials used in biosensors might be modified to facilitate diagnosis with more delicate sensing especially for the biomarkers of some diseases with a very minute concentration at their early stages. For gaining and improving such features, graphene, CNTs and MONs, should be produced with minimum catalyst impurities, high crystallinity, and in massive amounts in a cost-effective way. They should also be engineered for their density of states and the structure of bonds for tailoring a better electron transport properties. Within this review, a combination of nanostructures that help to develop an accurate 'future biosensor' mechanism was proposed and expectations as sensitivity, superior selectivity, low limit of detection, real-time sensing with multi-functional properties were summarized.
Disponibilité des données et des matériaux
Non applicable.
Abréviations
- 1D :
-
Unidimensionnel
- 3D :
-
Tridimensionnel
- CD:
-
Cyclodextrin
- CVD :
-
Dépôt chimique en phase vapeur
- CV :
-
Voltammogrammes cycliques
- DA :
-
Dopamine
- DNA:
-
Deoxyribonucleic acid
- DPV:
-
Differential pulse voltammetry
- FET :
-
Transistor à effet de champ
- GCE :
-
Electrode de carbone vitreux
- GelMA:
-
Gelatin methacryloyl
- GNPs:
-
Nanoplaquettes de graphène
- GNR :
-
Graphene nanoribbons
- GO :
-
Oxyde de graphène
- GQDs:
-
Graphene quantum dots
- LOD :
-
Limite de détection
- MIP:
-
Molecularly imprinted polymer
- MOF :
-
Metal organic frameworks
- MOs:
-
Metal oxides
- MWCNTs:
-
Multi-walled carbon nanotubes
- NHGH:
-
Nitrogen-doped porous graphene hydrogel
- NP :
-
Nanoparticules
- NRs:
-
Nanorods
- NSs:
-
Nanospheres
- NW :
-
Nanofils
- PANI :
-
Polyaniline
- PDADMAC:
-
Poly(diallyl dimethyl ammonium chloride)
- PDPA:
-
Poly Diphenylamine
- PECVD :
-
Dépôt chimique en phase vapeur assisté par plasma
- PEDOT:
-
Poly(3,4-ethylenedioxythiophene)
- PG :
-
Pristine graphene
- PPy :
-
Polypyrrole
- PTA:
-
Phosphotungstic acid
- PVA :
-
Alcool polyvinylique
- RF :
-
Fréquence radio
- rGO :
-
Oxyde de graphène réduit
- SERS :
-
Diffusion Raman améliorée en surface
- SWCNTs:
-
Single-walled carbon nanotubes
- UA :
-
Acide urique
- XO:
-
Xanthine oxidase
Nanomatériaux
- Présentation du métal réfractaire Rhénium
- Nanotubes de titanate Nanocomposites d'oxyde de graphène décoré :préparation, ignifugation et photodégradation
- Biosécurité et capacité antibactérienne du graphène et de l'oxyde de graphène in vitro et in vivo
- Les échafaudages nHAC/PLGA hybrides à l'oxyde de graphène facilitent la prolifération des cellules MC3T3-E1
- Évaluation des structures graphène/WO3 et graphène/CeO x en tant qu'électrodes pour les applications de supercondensateurs
- Un aperçu pour les débutants :qu'est-ce que la fabrication métallique ?
- Un aperçu des matrices d'emboutissage de tôle
- Un aperçu de la tôle de soudage par points
- Un aperçu de la tôle mince



