Fabrication d'acier à l'hydrogène
Aciérie à l'hydrogène
L'industrie sidérurgique est le secteur le plus important en termes d'émissions fossiles et industrielles totales mondiales, représentant environ 7 % à 9 % des émissions de gaz à effet de serre (GES). Dans le même temps, l'acier est le matériau de base des sociétés industrielles modernes. Une nouvelle augmentation de la consommation d'acier va se produire en raison de la nécessité d'étendre et d'améliorer les infrastructures et d'augmenter le niveau de vie mondial à un rythme suffisant pour atteindre un niveau satisfaisant. Par conséquent, il est difficile de trouver un processus de fabrication de l'acier qui permette une utilisation sociétale de l'acier en tant que matériau, tout en évitant les impacts environnementaux négatifs de sa production. Dans le contexte de la réduction des émissions de CO2 (dioxyde de carbone) de la sidérurgie, la filière sidérurgique à base d'hydrogène (H2) fait actuellement l'objet de beaucoup d'attention car elle constitue un choix attractif.
La réduction du minerai de fer avec H2 est bien connue puisque les réactions de réduction avec H2 ont également lieu aussi bien dans la production de métal chaud dans un haut fourneau (BF) que dans la production de fer réduit directement (DRI) / fonte briquetée à chaud ( HBI) dans un four à cuve. Dans la sidérurgie BF, les sources de H2 sont un jet d'air chaud humidifié et du charbon pulvérisé injecté. Dans le cas de la voie sidérurgique basée sur DR-EAF (réduction directe - four à arc électrique), elle a toujours été historiquement caractérisée par l'utilisation de H2, qui est normalement généré à partir de gaz naturel (GN) via des reformeurs catalytiques. Comme la source d'hydrocarbure est le GN, le H2 produit peut être de concentration variable et mélangé avec du monoxyde de carbone (CO), selon le taux d'oxydant utilisé.
La réduction H2 du minerai de fer est étudiée depuis de nombreuses décennies. Il y a eu des recherches pionnières en Suède par Wiberg et Edstrom dès les années 1950, qui ont été suivies par un certain nombre de recherches décrivant la cinétique du processus ainsi que la réactivité du produit fabriqué. La première usine de réduction directe H2 de minerai de fer (H2-DRI) à l'échelle commerciale basée sur la technologie du lit fluidisé, Circored, a été construite par Cliffs and Associates Ltd. au complexe industriel de Point Lisas à Trinidad en 1998. L'usine avait une capacité de 500 000 tonnes par an de HBI. L'usine n'a pas réussi commercialement et a été fermée en 2016.
Dans le scénario mondial actuel, plusieurs activités sont en cours pour trouver un procédé qui utilise la réduction du minerai de fer avec du H2 afin de réduire considérablement les émissions de CO2, voire de l'éliminer totalement. Il existe de nombreux problèmes qui doivent être surmontés avant que le succès ne soit atteint et qui peuvent fournir une concurrence féroce aux procédés actuels utilisés pour la fabrication du fer et de l'acier. Certains des principaux problèmes à surmonter sont décrits dans les paragraphes suivants.
L'une des questions importantes est de trouver une méthode rentable pour la production de H2 en vrac qui utilise l'énergie produite à partir de processus avec de faibles émissions de CO2. Les sources d'énergie renouvelable sont l'énergie solaire, l'énergie éolienne, l'énergie hydraulique, l'énergie marine et l'énergie géothermique. Dans l'énergie nucléaire, des combustibles non fossiles sont également utilisés. Parmi toutes les énergies renouvelables, les deux sources d'énergie renouvelable les plus fiables sont l'énergie solaire photovoltaïque (PV) et les éoliennes. Cependant, ces deux technologies se caractérisent par une alimentation électrique fluctuante en raison de la nature volatile du rayonnement solaire et du vent, de sorte qu'il y a des moments où l'approvisionnement en électricité est rare et des moments où il est abondant. Pour intégrer une forte proportion d'énergie éolienne et solaire dans le système énergétique, une solution de stockage à grande échelle est nécessaire pour compenser les déséquilibres temporels entre la production et la demande.
Le second enjeu est le stockage du vrac H2 (stockage gazeux haute pression ou stockage liquéfié cryogénique). Le stockage d'H2 présente des avantages du point de vue de l'approvisionnement en électricité et de la tarification, mais il n'est pas en tant que tel critique pour le concept de processus. Aujourd'hui, l'alternative la plus rentable pour le stockage de H2 est le stockage souterrain sous pression, où il y a stockage de H2 dans les formations souterraines de sel. Dans le scénario actuel, c'est la seule technologie de stockage de H2 qui a été testée à l'échelle industrielle. D'autres solutions qui suscitent beaucoup d'intérêt aujourd'hui incluent l'utilisation de gazoducs et la conversion en ammoniac ou en hydrocarbures comme stockage intermédiaire de H2. L'évaluation initiale de la technologie Lined Rock Cavern (LRC) utilisée actuellement en Suède pour le gaz naturel est considérée comme prometteuse. D'autres méthodes alternatives de stockage de H2 en cours de développement sont le stockage dans des hydrures métalliques et dans des matériaux poreux.
Le troisième problème est que le fer produit par réduction par H2 ne contient pas de carbone (C) contrairement au métal chaud et au DRI / HBI qui contiennent du C en pourcentage variable. C est nécessaire dans la fabrication de l'acier pour l'ébullition du C. L'acier tire également ses propriétés de sa teneur en C et, par conséquent, un pourcentage variable de C est présent dans différentes nuances d'acier. Cependant, de réelles difficultés techniques à cet égard ne sont pas anticipées puisque du C supplémentaire peut être ajouté dans l'EAF.
Le quatrième problème concerne les émissions de CO2 qui se produisent lors de l'extraction, du traitement et de l'enrichissement du minerai de fer et lors de la production de granulés ainsi que du transport de ces matériaux. Les procédés utilisant la réduction de H2 ont de préférence besoin de granulés comme matériau d'alimentation. À cet égard, il est possible d'éliminer une partie des émissions de CO2 en utilisant des sources d'énergie renouvelables.
Le premier procédé est la production à grande échelle de H2, qui est actuellement réalisée par reformage à la vapeur de méthane. Cette option peut être conservée et même optimisée pour la fabrication de fer à base de H2, par exemple en ciblant une pureté de 97 % à 98 % de H2 au lieu de la pureté normale de 99,9 % et plus. Cependant, étant basé sur une ressource fossile, la performance en termes d'atténuation du CO2 reste globalement moyenne, à moins qu'une unité de captage du CO2 ne soit ajoutée, ce qui représente une stratégie différente de celle poursuivie actuellement. L'autre option préférable est de produire du H2 par électrolyse de l'eau. La production de H2 doit être sans énergie fossile et, par conséquent, la méthode de production appropriée est l'électrolyse de l'eau avec de l'électricité pauvre en CO2, c'est-à-dire de l'énergie électrique renouvelable ou nucléaire. L'enjeu est de parvenir à une production massive d'H2 dans des conditions économiques acceptables. Bien que l'électrolyse de l'eau soit une technologie bien connue, des développements sont nécessaires pour atteindre l'objectif de quantités massives d'H2 pauvre en CO2 et surtout abordable pour la sidérurgie. La taille de l'installation peut être obtenue en multipliant les cellules d'électrolyse. De nouvelles technologies améliorées ont également été identifiées, telles que les membranes échangeuses de protons et l'électrolyse à haute pression ou à haute température.
Le deuxième procédé consiste à produire du fer par réduction directe du minerai de fer dans un four à cuve qui fonctionne uniquement avec du H2. C'est le cœur du procédé de fabrication du fer H2. Le four à cuve est alimenté en boulettes ou en morceaux par le haut, qui descendent par gravité et rencontrent un flux ascendant d'H2, alimenté latéralement à mi-hauteur du réacteur et sortant par le haut. Les réactions de réduction ont lieu dans la partie supérieure entre la sortie et l'entrée des gaz réducteurs. La conversion en fer s'achève au niveau de l'arrivée de gaz. Ci-dessous, une section conique peut être utilisée pour refroidir le DRI, mais de préférence en utilisant H2 au lieu de méthane (CH4). Le reste du circuit de gaz est beaucoup plus simple que celui du procédé DRI conventionnel avec du GN reformé, le gaz de tête composé de H2-H2O étant refroidi pour condenser l'eau. Le H2 séparé est recyclé, mélangé avec du H2 frais provenant de l'usine d'électrolyse et réchauffé à la température souhaitée (environ 800 à 900 deg C).
A partir de la modélisation mathématique de la zone de réduction d'un four à cuve fonctionnant à 100 %. H2, il a été constaté qu'en raison de la cinétique de réduction rapide avec H2, une métallisation complète peut théoriquement être obtenue plus rapidement qu'avec le mélange H2-CO, ce qui donne des réacteurs plus petits que les puits DR actuels.
Le troisième processus est la fusion du DRI sans C dans un EAF pour produire de l'acier. Un processus de réduction basé sur H2 donne un produit de fer sans carbone, ce qui indique qu'une source de carbone sans fossile est nécessaire pour produire un produit en acier de la chimie requise dans l'étape de fabrication de l'acier.
Dans la meilleure voie de fabrication d'acier à base de H2 étudiée dans le projet ULCOS (ultra low CO2 steelmaking) (Fig1), le H2 est considéré comme étant produit par électrolyse de l'eau à l'aide d'électricité hydraulique ou nucléaire. Le minerai de fer est considéré comme étant réduit en DRI par H2 dans un four à cuve, et le DRI sans C est considéré comme étant traité dans un EAF pour produire de l'acier. Cette voie présente des performances prometteuses en matière d'émissions de CO2 qui sont inférieures à 300 kg CO2 / tonne d'acier, y compris le coût CO2 de l'électricité avec les émissions du four DR (réduction directe) lui-même quasi nulles. Cela représente une réduction de 85 % des émissions de CO2 par rapport aux 1 850 kg CO2 actuels / tonne d'acier de la voie BF-BOF (four à oxygène basique). Cette nouvelle voie est donc une manière plus durable de produire de l'acier. Cependant, son développement futur est largement tributaire de l'émergence d'une économie dite H2, lorsque ce gaz sera disponible en grande quantité, à un coût compétitif, et avec de faibles émissions de CO2 pour sa production.
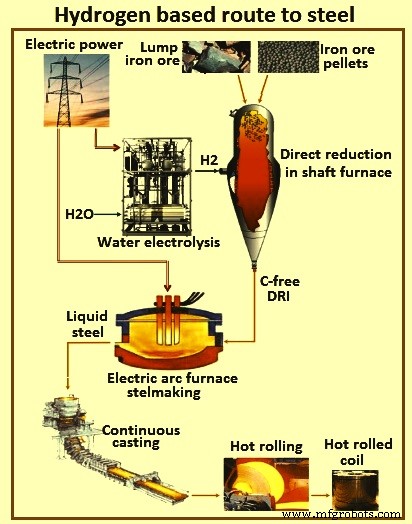
Fig 1 Parcours de fabrication d'acier à base d'hydrogène
Dans la réduction basée sur H2, le minerai de fer est réduit par une réaction gaz-solide, similaire aux voies DRI. Le seul facteur de différenciation est que l'agent réducteur est du H2 pur au lieu du gaz CO, du gaz de synthèse ou du coke. La réduction du minerai de fer par H2 se déroule en deux ou trois étapes. Pour des températures supérieures à 570°C, le minerai d'hématite (Fe2O3) est d'abord transformé en magnétite (Fe3O4), puis en wustite (FexO), et enfin en fer métallique alors qu'à des températures inférieures à 570°C, la magnétite est directement transformée en fer depuis la wustite n'est pas thermodynamiquement stable.
Les réactions de réduction impliquées dans la réduction du minerai de fer par H2 sont représentées par les équations (i) 3 Fe2O3 + H2 =2 Fe3O4 + H2O, (ii) x Fe3O4 + (4x-3) H2 =3 FexO + (4x-3 ) H2O, et (iii) FexO + H2 =x Fe + H2O où x est égal à 0,95. Comme l'indiquent ces réactions, la réduction du minerai de fer avec H2 libère des vapeurs d'eau inoffensives (H2O) au lieu du gaz à effet de serre CO2. La réaction globale pour la réduction du minerai d'hématite avec H2 est Fe2O3 + 3H2 =2Fe + 3H2O qui est une réaction endothermique avec une chaleur de réaction, delta H à 298 degrés C =95,8 kJ/mol, ce qui est négatif pour le bilan énergétique de la procédé et demande un apport d'énergie avec le mélange gaz de réduction/gaz injecté. Lors du développement de la ligne de production, l'accent est mis sur l'optimisation basée sur la température de réduction, la cinétique de la réaction, la composition des granulés et la technologie de préchauffage du gaz de réduction.
La consommation stoechiométrique de H2 pour la réduction du minerai d'hématite (Fe2O3) est de 54 kg par tonne de fer. Par conséquent, une aciérie d'un million de tonnes par an nécessite une usine de H2 d'une capacité allant jusqu'à 70 000 m3 / heure de H2 à température et pression standard (STP). Avec H2 comme gaz réducteur, il est important d'anticiper le changement de comportement du réacteur par rapport au réacteur avec des mélanges H2-CO comme gaz réducteur (Fig 2). Plusieurs facteurs peuvent interagir de différentes manières, tels que la cinétique, la thermodynamique, le transfert de chaleur et le débit de gaz. Concernant la cinétique, les études en laboratoire sur la réduction des oxydes de fer avec le CO, le H2 et les mélanges CO–H2 ont clairement montré que, toutes choses égales par ailleurs, la cinétique avec le H2 est plus rapide (jusqu'à 10 fois) que celle avec le CO. des caractéristiques de la réaction sont très similaires à celle de la réduction par le CO et de nombreux mécanismes sont communs aux deux. Cependant, il existe également des différences significatives.
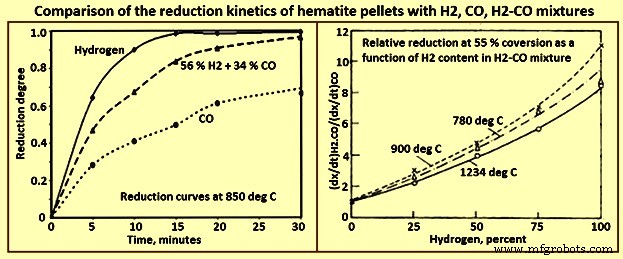
Fig 2 Comparaison de la cinétique de réduction des pastilles d'hématite avec des mélanges H2, CO et H2-CO
Le premier facteur majeur est la thermodynamique, qui favorise le CO à basse température, comme en témoigne le diagramme de Chaudron (Fig 3). Les flèches bleues verticales représentent la force motrice de la réduction de wustite en fer, qui augmente avec la température avec H2 et diminue avec la température avec CO.
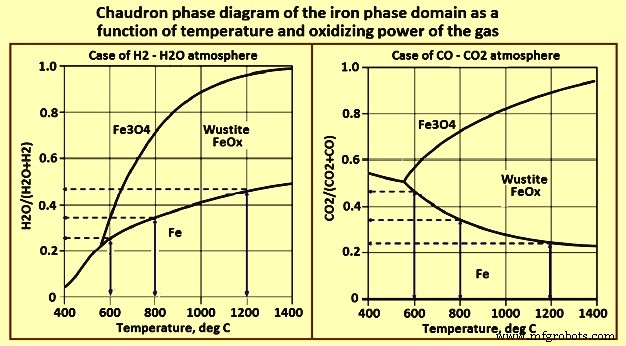
Fig 3 Diagramme de phase de Chaudron du domaine de la phase fer en fonction de la température et du pouvoir oxydant du gaz
Le deuxième facteur est la chaleur des réactions de réduction, comme indiqué dans l'onglet 1. La réaction hématite-magnétite est moins exothermique avec H2 qu'avec CO, la réaction magnétite-wustite est plus endothermique, et principalement, la wustite- La réaction au fer est endothermique avec H2 et exothermique avec CO. Dans l'ensemble, l'équilibre est une réduction endothermique avec H2 et une réduction exothermique avec CO. En conséquence, la température et les compositions dans le puits changent considérablement avec la composition du gaz d'admission. En sortie de zone d'injection de gaz, la température diminue à cause du craquage du méthane, mais avec une teneur en CO plus élevée, le lit est maintenu à une température plus élevée du fait de la chaleur exothermique des réactions de réduction, alors que la température est plus basse avec plus de H2 .
| Tab1 Valeurs thermiques des réactions de réduction | |
| Réaction | Delta H, 800 degrés C |
| J/mol | |
| 3Fe2O3 + H2 + 2 Fe3O4 =H2O | – 6 020 |
| 3Fe2O3 + CO =2 Fe3O4 + CO2 | – 40 040 |
| Fe3O4 + H2 =3 FeO + H2O | 46 640 |
| Fe3O4 + CO =3 FeO + CO2 | 18 000 |
| FeO + H2 =Fe + H2O | 16 410 |
| FeO + CO =Fe + CO2 | – 17 610 |
| Remarque :un signe moins indique une réaction exothermique | |
Même si dans tous les cas, plus de H2 que de CO est globalement utilisé pour les trois réductions (résultat de la cinétique), ce dernier effet, c'est-à-dire la réduction par le CO dans la zone centrale en cas de gaz CO, est déterminant quant au résultat final. degré de métallisation. De plus, lorsqu'on utilise uniquement H2 (à la fois à l'entrée du gaz réducteur et à l'entrée inférieure), la zone centrale plus froide n'existe pas, les températures sont plus uniformes radialement et la réduction, due à la cinétique efficace, va jusqu'à son terme (100 % métallisation).
Comme on l'a vu plus haut, la réduction avec H2 est endothermique, alors qu'elle est exothermique avec CO. En revanche, la thermodynamique est plus favorable avec H2 qu'avec CO au-dessus de 800°C. Cela rend le fonctionnement industriel différent. Avec H2, le gaz chaud amené doit apporter suffisamment de calories pour chauffer et maintenir le solide à une température suffisamment élevée pour que la réaction se produise. Un fonctionnement avec un débit de gaz supérieur à la stoechiométrie est donc nécessaire. La cinétique est également signalée comme étant plus rapide avec H2. Cela peut à son tour modifier la morphologie du produit final (le fer), qui dépend d'une compétition entre la diffusion et la réaction chimique. En particulier, la formation de moustaches apparaît comme une spécificité de la réduction par H2. Les moustaches sont des grains de fer dépassant de la phase wustite et se développant comme des doigts vers l'extérieur des particules. Les whiskers rendent les contacts fer-fer plus fréquents et peuvent ainsi expliquer le phénomène de collage des particules solides, parfois rencontré dans les réacteurs industriels fonctionnant à forte teneur en H2. Un autre phénomène gênant observé avec la réduction de H2 est l'apparition, à certaines températures, d'un ralentissement en fin de réaction pour atteindre le dernier pourcentage de degré de conversion.
Dans un four à cuve avec de l'H2 pur, il n'y a pas de source de C. En raison de la nature endothermique des réactions, une grande quantité de chaleur est absorbée et la température interne au niveau de la couche de matériau en vrac diminue rapidement. De ce fait, les réactions de réduction qui nécessitent une forte consommation de chaleur entraînent une détérioration du taux d'utilisation du gaz. La quantité de H2 en tant que caloporteur doit être augmentée pour maintenir la productivité souhaitée. Par exemple, lorsque la pression au sommet est de 0,4 MPa, la quantité de H2 à une température de 900 °C doit être d'au moins 2 600 m3 par tonne de DRI pour répondre à la demande de chaleur de la réduction du four à cuve. Si l'ajout de H2 reste inchangé, la sortie du DRI est inférieure d'un tiers à celle du présent, ce qui entraîne une forte augmentation du coût de production du DRI.
La gravité spécifique de H2 est faible et la densité de H2 n'est que de 1/20 fois celle de CO. En conséquence, la molécule de gaz H2 entrant s'échappe rapidement vers le haut. En comparaison avec le chemin et la direction d'un gaz réducteur mixte, ceux de H2 dans un four changent si rapidement que H2 ne peut pas rester dans la zone à haute température à la partie inférieure du four à cuve pour terminer la tâche de réduction des boulettes de minerai de fer. Théoriquement, les produits DRI peuvent également atteindre l'indice de conception en maintenant le H2 entrant avec une pression supérieure à 1 MPa et une température supérieure à 1 000 degrés C.
De plus, le H2 est une substance extrêmement inflammable et explosive, et le four à cuve nécessite une production hautement efficace et stable à long terme. Si le système de four à cuve est autorisé à fonctionner pendant une longue période dans les conditions ultimes de haute température et de haute pression, la sécurité devient un problème. En bref, le taux de réduction directe et l'efficacité de la production sont affectés par plusieurs facteurs, tels que la proportion de H2, la température, la pression, le taux d'utilisation du gaz, le temps de séjour du minerai de fer, le transfert de chaleur, le transfert de masse et la conception du four à cuve.
L'initiative HYBRIT
HYBRIT est l'abréviation de « HYdrogen Breakthrough Ironmaking Technology ». Le 4 avril 2016, les trois sociétés suédoises SSAB, LKAB et Vattenfall AB ont lancé un projet visant à étudier la faisabilité d'un processus de production DRI basé sur H2, avec de l'électricité sans émission de CO2 comme principale source d'énergie. Une coentreprise a été créée, HYBRIT Development AB, dont les trois sociétés sont propriétaires. Cela donne un accès complet aux meilleures compétences dans l'ensemble de la chaîne de valeur de la production d'énergie, de l'exploitation minière, de la valorisation du minerai et de la production de boulettes, de la réduction directe, de la fusion et de la production d'acier brut. Une étude de préfaisabilité sur la réduction directe basée sur le H2 a été réalisée en 2017. L'étude a conclu que le procédé proposé est techniquement faisable et, compte tenu des tendances futures des coûts des émissions de CO2 et de l'électricité, il est également économiquement attractif pour les conditions de nord de la Suède / Finlande.
Le procédé HYBRIT remplace le charbon par H2 pour la réduction directe (DR) du fer, associé à un EAF. Le processus est presque entièrement sans fossile et entraîne une réduction substantielle de ses émissions de gaz à effet de serre. Le processus fait partie de plusieurs initiatives qui utilisent une configuration H2-DR / EAF, combinant la réduction directe du minerai de fer par l'utilisation de H2 avec un EAF pour une transformation ultérieure en acier. Le produit du procédé H2-DR est du DRI ou du fer spongieux, qui est introduit dans un EAF, mélangé avec des parts appropriées de ferraille, et ensuite transformé en acier.
Le schéma de principe du procédé de production HYBRIT est illustré à la Fig 4. Les principales caractéristiques du procédé sont (i) des combustibles non fossiles sont utilisés dans la production de granulés, (ii) le H2 est produit par électrolyse à l'aide d'électricité non fossile, (iii) le stockage de H2 dans une unité spécialement conçue est utilisé comme tampon pour le réseau, (iv) un four à cuve est utilisé pour la réduction du minerai de fer, (v) des pastilles sur mesure sont utilisées comme alimentation en minerai de fer, (vi) le gaz de réduction / le mélange gazeux est préchauffé avant injection dans le puits, (vii) le produit peut être soit DRI ou HBI exempt de C ou carburé, et (viii) le DRI / HBI est fondu avec la ferraille recyclée dans un EAF.
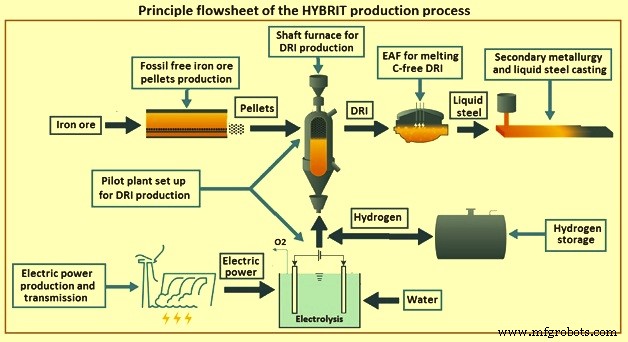
Fig 4 Schéma de principe du processus de production HYBRIT
L'utilisation d'H2 produit par électrolyse de l'eau à partir d'électricité non fossile pour réduire les boulettes de minerai de fer dans un four à cuve est la principale alternative retenue pour l'initiative HYBRIT. Dans le cadre de cette initiative, une conversion vers une chaîne de valeur sans énergie fossile, de la mine à l'acier fini, comprend de nombreux enjeux à développer où le marché local et les conditions géographiques sont également pris en considération. La Suède a une situation unique avec une surcapacité d'électricité dans la partie nord du pays, la proximité de mines de minerai de fer, un bon accès à la biomasse et aux aciéries, et un solide réseau entre l'industrie, les instituts de recherche et les universités.
Le procédé HYBRIT appartient à une catégorie de concepts technologiques sensiblement plus proche du déploiement commercial. Il est basé sur l'utilisation de H2 comme réducteur, le H2 étant produit par électrolyse à partir d'électricité renouvelable. D'un point de vue environnemental, l'avantage le plus important de ceci est que l'échappement de ce processus est de l'eau (H2O) au lieu de CO2, avec une réduction conséquente des émissions de GES. Comme pour la fabrication d'acier DRI conventionnelle, le fer produit à l'aide de la voie DRI à base de H2 peut être transformé en acier à l'aide de la technologie EAF disponible dans le commerce. Les étapes de production de H2 et de fabrication d'acier EAF peuvent être rendues sans C si l'énergie électrique et le H2 sont produits à l'aide de sources renouvelables telles que l'électrolyse solaire / éolienne / hydroélectrique PV (photovoltaïque), la production photochimique de H2 ou l'eau solaire thermique fractionnement.
Technologie de fabrication de fer éclair utilisant de l'hydrogène
Une nouvelle technologie de transformation pour la fabrication de fer alternatif est en cours de développement par un consortium d'organisations et d'instituts avec le soutien financier de l'American Iron and Steel Institute aux États-Unis. Cette technologie est basée sur la réduction gazeuse directe du concentré d'oxyde de fer dans un procédé de réduction flash. La nouvelle «technologie de fabrication de fer éclair (FIT) a le potentiel de réduire la consommation d'énergie de 32 % à 57 % et les émissions de CO2 de 61 % à 96 % par rapport à l'opération actuelle moyenne basée sur BF. Cette technologie réduit le concentré de minerai de fer dans un réacteur flash avec un gaz réducteur approprié tel que H2 ou du gaz naturel, et éventuellement du bio/gaz de charbon ou une combinaison de ceux-ci. C'est le premier processus de fabrication de fer instantané. Cette technologie convient à une opération industrielle qui convertit le concentré de minerai de fer (moins de 100 microns) en métal sans autre traitement.
Cette technologie transformatrice produit du fer tout en contournant la pelletisation ou le frittage ainsi que les étapes de fabrication de coke. De plus, le processus est intensif en raison du fait que les fines particules du concentré sont réduites à une vitesse rapide de 1 150 deg C à 1 350 deg C. Ainsi, les temps de séjour requis dans ce processus sont de l'ordre de quelques secondes plutôt que de minutes et heures nécessaires pour les pellets et même les fines de minerai de fer. Des réductions de 90 % à 99 % ont lieu en 2 secondes à 7 secondes entre 1 200 deg C et 1 500 deg C. Le temps de séjour est une combinaison de la vitesse de réaction due à la température, à la taille du matériau d'alimentation et à la quantité de gaz en excès / à la distance de ligne d'équilibre. Le besoin énergétique du procédé avec H2 comme gaz réducteur est de 5,7 GJ (1 360 Mcal)/tonne de fonte liquide. Le diagramme d'équilibre Fe/FeO est représenté sur la figure 5.
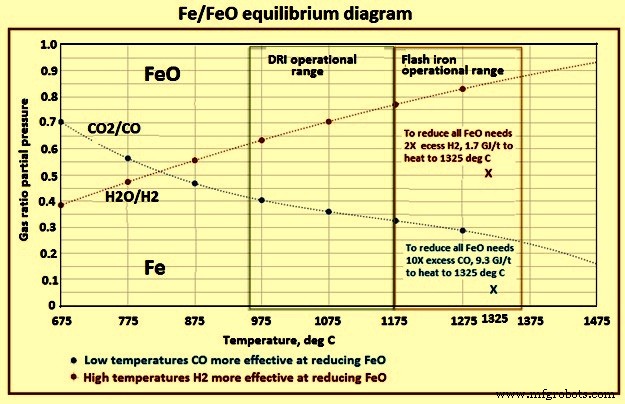
Fig 5 Diagramme d'équilibre Fe/FeO
La partie chauffante du réacteur est l'endroit où la bobine de chauffage par induction chauffe le suscepteur en graphite. Le suscepteur chauffe la paroi réfractaire par rayonnement. Le suscepteur et le réfractaire chauffent le gaz et les particules par convection et rayonnement. Après avoir été chauffés à la température, le gaz et les particules pénètrent dans la zone de réaction, où une bonne isolation est supposée, de sorte que l'état de la paroi est défini comme adiabatique. Après la zone de réaction, il y a une zone de refroidissement avec un panneau de refroidissement pour refroidir les gaz et les particules. La figure 6 montre le schéma de principe de la technologie de fabrication de fer flash.
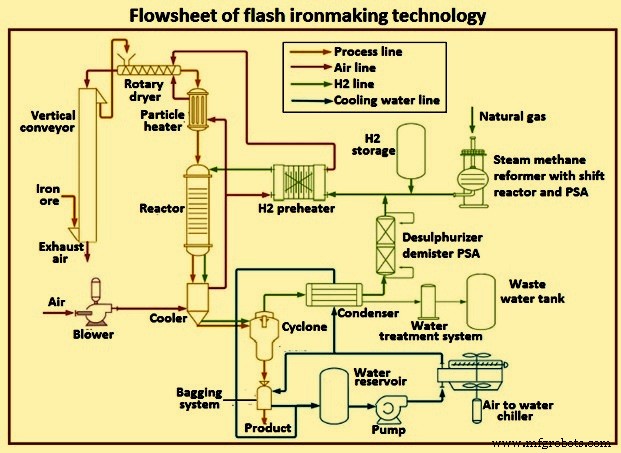
Fig 6 Schéma de principe de la technologie de fabrication de fer flash
En cas de FIT avec H2 comme gaz réducteur, les émissions de CO2 sont de 0,04 tonne de CO2 par tonne de fonte liquide. Ces émissions représentent 2,5 % des émissions de la voie BF de la sidérurgie. Le processus de flash iron est effectué à une température suffisamment élevée pour que les particules individuelles aient suffisamment d'énergie pour fermer les pores créés par l'élimination de l'oxygène. Par conséquent, les particules individuelles sont beaucoup moins susceptibles de s'enflammer à cause d'une oxydation rapide. L'Université de l'Utah a effectué des recherches sur de petits échantillons de poudre et a déterminé qu'ils n'étaient pas pyrophoriques.
Le procédé utilise des agents réducteurs gazeux tels que NG, H2, gaz de synthèse ou une combinaison de ceux-ci. Elle doit être appliquée à la production de fer en tant qu'alimentation du processus de fabrication de l'acier ou partie d'un processus continu de fabrication directe de l'acier. Justifiés par des données expérimentales obtenues lors de la phase précédente du projet, des travaux de développement à grande échelle sont actuellement en cours à l'Université de l'Utah. Les essais dans un four flash de laboratoire ont abouti à l'établissement d'une base de données cinétiques sur de larges plages de conditions de fonctionnement et à la conception complète d'un réacteur de banc plus avancé. Dans le but de développer un FIT industriellement viable, une campagne complète d'essais à l'échelle du banc est prévue. Les livrables de cette phase du projet devraient être la détermination de l'évolutivité du processus, des résultats de simulation de processus substantiels et des données d'ingénierie fondamentales menant à la conception et à la construction d'une usine pilote industrielle.
Processus de fabrication
- Alliage de stockage d'hydrogène titane-fer
- Qu'est-ce que la fabrication d'acier à l'oxygène de base ?
- Kazoo
- Harpe
- Mousse de polystyrène expansé (EPF)
- Capteurs Raspberry Pi
- Une introduction à la fragilisation par l'hydrogène
- Qu'est-ce qu'une carrière ?
- Diverses méthodes de processus de fabrication de l'acier



